Transition vitreuse
La transition vitreuse est un ensemble de phénomènes physique associés au passage d'un état de liquide surfondu à un état solide, qualifié de vitreux. Elle caractérise le passage entre la forme dure et relativement cassante et la forme « fondue » ou caoutchouteuse d'un matériau amorphe (ou d'un matériau semi-cristallin avec des régions amorphes)[1]. Un solide amorphe qui montre une telle forme de transition vitreuse est appelé un verre. Le refroidissement intense d'un liquide visqueux vers sa forme vitreuse est appelé la vitrification.
Définition
La transition vitreuse est un ensemble de phénomènes physiques associés au passage d'un état de liquide surfondu à un état solide, qualifié de vitreux[2] - [3]. Par définition, lors d'une transition vitreuse, la viscosité se situe entre 1012 et 1014 Pa.s[2].
La température à laquelle cette transition a lieu s'appelle la température de transition vitreuse, communément notée Tg[2] - [3]. Elle augmente lorsque le refroidissement accélère[2]. La transition vitreuse n’a pas lieu à une température unique, mais sur une gamme de température. Pour cette raison, la Tg peut être déterminée en début, au milieu, comme à la fin de la transition.
Le matériau obtenu en-dessous de la température de transition vitreuse, appelé verre, possède une structure que l'on peut supposer proche de celle du liquide à la température Tg[3], et donc sans ordre à longue portée[Note 1]. Puisque la structure d'un liquide dépend de sa température, un verre ayant subi une trempe rapide (Tg élevée) a une structure plus « ouverte » qu'un verre ayant subi un refroidissement lent (Tg faible)[2] - [3].
Propriétés
Une rupture de pente se produit si on représente l'évolution de certaines grandeurs (volume spécifique, masse volumique, enthalpie, indice de réfraction, etc.) du matériau en fonction de sa température[3]. La continuité des grandeurs thermodynamiques lors du changement d'un état liquide vers un état solide est caractéristique de la transition vitreuse[4]. Cette continuité des grandeurs signifie qu'il n'y a pas de libération ou d'absorption de chaleur latente : la transition est dite de second ordre, et n'est généralement pas qualifiée de transition de phase.
La transition vitreuse n’est pas réversible et elle est dépendante du temps, c’est-à-dire qu’elle est affectée par les conditions expérimentales telles que la vitesse de chauffage ou de refroidissement. Plusieurs paramètres influencent la température de transition vitreuse, les plus importants étant la composition chimique, la présence d’eau et les propriétés physiques.
Malgré les changements des propriétés physiques du matériau lors de sa transition vitreuse, celle-ci n'est pas considérée pour autant comme un changement de phase ; elle est plutôt décrite comme un phénomène de laboratoire se produisant sur une certaine gamme de températures et définie par plusieurs conventions[5] - [6]. Ces conventions incluent entre autres un taux de refroidissement constant (20 K/min)[1] et un seuil de viscosité de 1 × 1012 Pa s. Refroidi ou chauffé dans cette gamme de transition vitreuse, le matériau montre une progression douce de son coefficient de dilatation thermique et de sa capacité thermique, la localisation de ces effets dépendant de l'historique du matériau[7]. Cependant, le fait de savoir si une transition de phase « sous-tend » cette transition vitreuse fait toujours l'objet de recherches[5] - [6] - [8].
La température de transition vitreuse (Tg) du matériau amorphe est toujours plus basse que le point de fusion de sa forme cristalline, si ce matériau existe également sous cette forme.

En raison de sa structure amorphe, les verres produisent, en diffraction des rayons X (DRX), un halo de diffusion, contrairement aux cristaux qui donnent des pics étroits et intenses.
Méthodes de mesure
Les méthodes les plus courantes pour déterminer la transition vitreuse sont l'analyse thermique différentielle et la dilatométrie[3].
Exemples et applications
Fabrication d'un verre
La méthode traditionnelle pour former un verre consiste à tremper le liquide après la fusion en évitant la cristallisation. En effet, le passage de l’état liquide à l’état cristallin n’est pas instantané. Cette transition se produit à une température inférieure à la température de fusion et résulte de la compétition entre une force motrice de transformation et la dynamique des molécules.
Silice
Un verre peut être vu comme un « réseau » tridimensionnel, semblable à celui d’un cristal, mais dans lequel seul l’ordre à courte distance est conservé. Comparons, par exemple, la structure de la silice (SiO2) cristalline (sous sa forme cristobalite) et celle de la silice vitreuse :
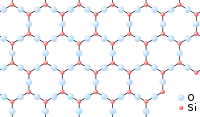 Représentation schématique bi-dimensionnelle de la silice cristalline (cristobalite).
Représentation schématique bi-dimensionnelle de la silice cristalline (cristobalite).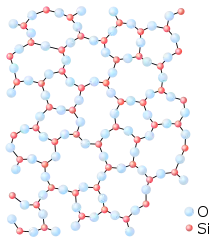 Représentation schématique bi-dimensionnelle de la silice vitreuse.
Représentation schématique bi-dimensionnelle de la silice vitreuse.
Dans les deux cas, chaque atome de silicium est lié avec quatre atomes d’oxygène, formant ainsi des tétraèdres SiO4 ; chaque tétraèdre pouvant être considéré comme une « brique » de l’édifice final. Mais tandis que la cristobalite peut être définie comme un empilement régulier de ces briques SiO4, la silice vitreuse peut être considérée comme un empilement anarchique de ces mêmes briques SiO4.
Tréhalose
_du_tr%C3%A9halose.JPG.webp)
La figure 1 montre un exemple de la transition vitreuse du tréhalose qui est un disaccharide composé de deux molécules de glucose ; ce sucre est semblable à celui qu’on utilise quotidiennement, mais deux fois plus énergétique. La transition vitreuse intervient à une température voisine de 120 °C.
Notes et références
Notes
Références
- (en) ISO 11357-2: Plastics – Differential scanning calorimetry (DSC) – Part 2: Determination of glass transition temperature (1999).
- Jean Phalippou, « Verres - Aspects théoriques - Transition vitreuse », sur techniques-ingenieur.fr, (consulté le )
- Encyclopædia Universalis, « État vitreux » (consulté le )
- « vitreux », dictionnaire Larousse (consulté le )
- (en) P. G. Debenedetti, « Supercooled liquids and the glass transition », Nature, vol. 410, no 6825, , p. 259–267 (PMID 11258381, DOI 10.1038/35065704, Bibcode 2001Natur.410..259D)
- (en) C. A. Angell, « Relaxation in glassforming liquids and amorphous solids », App. Phys. Rev., vol. 88, no 6, , p. 3113–3157 (DOI 10.1063/1.1286035, Bibcode 2000JAP....88.3113A)
- (en) Zarzycki, J., Glasses and the Vitreous State, Cambridge University Press, (ISBN 0-521-35582-6, lire en ligne)
- (en) M. I. Ojovan, « Glass formation in amorphous SiO2 as a percolation phase transition in a system of network defects », Journal of Experimental and Theoretical Physics Letters, vol. 79, no 12, , p. 632 (DOI 10.1134/1.1790021, Bibcode 2004JETPL..79..632O)
Voir aussi
Bibliographie
- James Barton et Claude Guillemet, Le Verre, Science et technologie, Les Ulis, EDP Sciences, , 440 p. (ISBN 2-86883-789-1)