Tétrathiafulvalène
Le tétrathiofulvalène, généralement abrégé en TTF, est un composé chimique hétérocyclique contenant du soufre de formule H2C2S2C=CS2C2H2.
| Tétrathiofulvalène | |
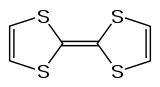
| |
| Structure du tétrathiofulvalène | |
| Identification | |
|---|---|
| Nom UICPA | 2-(1,3-dithiol-2-ylidène)-1,3-dithiole |
| Synonymes |
Δ2,2′-Bi-1,3-dithiole, TTF |
| No CAS | |
| No ECHA | 100.045.979 |
| No CE | 250-593-7 |
| PubChem | 99451 |
| SMILES | |
| InChI | |
| Apparence | cristaux orange |
| Propriétés chimiques | |
| Formule | C6H4S4 [Isomères] |
| Masse molaire[1] | 204,356 ± 0,025 g/mol C 35,26 %, H 1,97 %, S 62,77 %, |
| Propriétés physiques | |
| T° fusion | 190,1 à 191,3 °C [2] |
| Thermochimie | |
| ΔfH0solide | 290,8 kJ·mol-1 [3] |
| PCI | −5 619,5 kJ·mol-1[3] |
| Précautions | |
| SIMDUT[4] | |
Produit non contrôlé |
|
| NFPA 704 | |
| Unités du SI et CNTP, sauf indication contraire. | |
C’est une molécule organique symétrique, plane et géométriquement flexible[5]. Il est étudié intensivement en électronique moléculaire comme donneur d'électrons (composé de type p), notamment dans le cadre des complexes à transfert de charge qu'il forme avec le TCNQ.
Le TTF et ses dérivés sont stables dans divers états d'oxydation et sont principalement utilisés dans la synthèse de conducteurs moléculaires et de supraconducteurs. Ils forment notamment des sels de Bechgaard, qui deviennent supraconducteurs à basse température : c'est particulièrement le cas du TMTSF (tétraméthyltétrasélénafulvalène) et du BEDT-TTF (bis(éthylènedithio)-tétrathiofulvalène). Plus de dix mille publications scientifiques traitent du TTF et de ses dérivés[6].
Le TTF est appliqué dans de nombreux domaines. Par exemple, grâce à leurs propriétés, les dérivés à base de TTF agissent comme des chromophores organiques pour la sensibilisation des lanthanides à l'émission visible et proche infrarouge (NIR)[7]. Le TTF possède des propriétés semi-conductrices organiques dans certaines conditions, notamment car il permet le recouvrement des orbitales moléculaires entre molécules voisines, favorisant la conduction électronique. Le TTF est souvent utilisé comme ligand dans des complexes de coordination, par exemple comment agent de sensibilisation des terres rares à la luminescence[8].
Histoire
Un dérivé du TTF, le dibenzo-TTF avait d'abord été synthétisé en 1920, puis le diméthyl-TTF et diphényl-TTF dans les années 1960[8].
C’est seulement en 1972 qu’a été découvert le TTF en tant que premier semi-conducteur organique sous forme de sel [TTF]Cl (dissociable en TTF+ et Cl-)[8].
Depuis 1973, du fait de son fort potentiel dans de nombreux domaines, d’autres études sont menées, notamment sur de nouveaux aspects comme la phosphorescence[8].
Synthèse
Depuis sa découverte en 1972, de multiples méthodes de synthèse ont été élaborées avec des rendements variant entre 25% et 99%.
L'intérêt porté au TTF et à ses dérivés a conduit au développement de plusieurs synthèses de cette molécule et de ses analogues[6]. La plupart de ces préparations passe par le couplage de molécules ayant un noyau C3S2 cyclique comme les 1,3-dithiol-2-thiones ou les 1,3-dithiol-2-ones associées. Pour le TTF, la synthèse commence avec le trithiocarbonate H2C2S2C=S, qui est d'abord S-méthylé puis traité au tétrafluoroborate d'hydrogène HBF4 et enfin à la triéthylamine[9] :
- H2C2S2CH(SCH3) + HBF4 → [H2C2S2CH+]BF4− + HSCH3
- 2 [H2C2S2CH+]BF4− + 2 Et3N → H2C2S2C=CS2C2H2 + 2 Et3NHBF4
La synthèse du TTF peut être obtenue par diverses réactions, voici quelques exemples.
Synthèse du TTF à partir du TTN
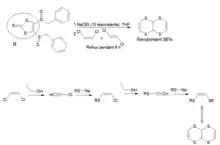
La réaction est thermodynamiquement favorable et se fait naturellement à température ambiante en 3 jours ou à reflux en 30 minutes lorsque l’on mélange le TTN, dont la synthèse a été décrite dans le 1er schéma à droite, avec du t-BuOK dans du THF(tétrahydrofurane)[10].
La réaction se déroule en deux étapes principales: une déprotonation suivie d’un réarrangement (2e schéma à droite).
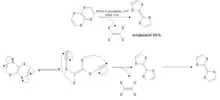
Synthèse de Adrian J. Moore et Martin R. Bryce (1997)
Une autre méthode pour synthétiser le TTF consiste à faire réagir du disulfure de carbone avec de la soude et de l’hexahydropyridine. Il s’agit d’une méthode en 5 étapes, peu coûteuse. Le rendement global de cette réaction est supérieur à 37%.
On peut relever que le composé 4 est utilisé pour la synthèse stéréosélective du dérivé TTF asymétrique. Le composé 8 est également un précurseur pour la synthèse du 2-dialkoxyphosphinyl-1,3-dithiole, qui est lui-même utilisé dans la synthèse des dérivés du 1,3-dithiol-2-ylidene[11].
.png.webp)
Propriétés redox
Le TTF de base est un bon donneur électronique, capable de 2 oxydations simples successives réversibles à des potentiels bas (respectivement 0,34 V et 0,78 V vs Ag/AgCl dans PhCN). Cette capacité à donner des électrons s’explique en partie par la formation d’un cycle de dithiolium, qui font du TTF oxydé une molécule aromatique selon les règles de Hückel[6].
Un des facteurs expliquant ces propriétés est la haute énergie de l’orbitale HOMO du TTF, qui favorise le don d’électrons. En revanche, les meilleurs matériaux conducteurs présentent un faible gap d’énergie entre leurs orbitales HOMO et LUMO, ce qui n’est pas le cas du TTF.
C’est avec l’objectif de réduire ce gap que des recherches extensives ont été menées entre le début des années 70 et le début des années 2000, donnant naissance à la plupart des solides moléculaires organiques supraconducteurs de l’époque[12]. Pour ce faire, on peut par exemple étendre la conjugaison dans la molécule, ou introduire des liaisons covalentes entre groupements donneurs et attracteurs.
De nos jours, les propriétés redox du TTF lui offrent des applications extrêmement variées, par exemple dans des cellules photovoltaïques[13], comme catalyseur ou intermédiaire lors de synthèse organique[12].
Applications
Fonctionnalisation du TTF
Le tétrathiafulvalène est l’une des molécules hétérocycliques ayant le plus fait l’objet de recherches, notamment pour ses propriétés électroniques[6].
Il a deux voies de fonctionnalisation : (i) en le synthétisant avec des précurseurs déjà fonctionnalisés, ce qui était la méthode la plus utilisée, (ii) en fonctionnalisant du tétrathiafulvalène déjà synthétisé.
Les méthodes les plus courantes pour y parvenir sont:
- la déprotection du soufre avec une base puis une alkylation ;
- lithiation de l’hydrogène lié au soufre puis réaction avec un électrophile (alcool, acide carboxylique,...). Les dérivés ainsi synthétisés sont par exemple utilisés dans les panneaux solaires ;
- une réaction Diels-Alder et une N-alkylation, qui donnent toutes deux des dérivés de tétrathiofulvalène symétriques.
Le tétrathiafulvalène peut également être fonctionnalisé en allongeant son système conjugué. Cela permet de diminuer la répulsion intra moléculaire. La principale raison de l’existence de cette voie est la recherche de matériaux transférant des charges avec des stœchiométries prédéfinies.
Ces dérivés de tétrathiofulvalène sont souvent synthétisés en combinant ce dernier avec des acènes. Cela a pour effet d’augmenter le potentiel oxydatif, ce qui est responsable entre autres de la stabilité des molécules formées pouvant rester plusieurs mois à l’air libre.
Luminescence
Les ligands à base de cœur TTF sont aptes à la construction de complexes d’ions lanthanides présentant individuellement des propriétés de luminescence[14].
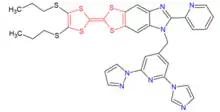
Les dérivés du TTF peuvent sensibiliser efficacement la luminescence à l’état solide dans le proche infrarouge, domaine de transparence des milieux biologiques. Avec par exemple, des éléments 4f sous formes d’ions Ytterbium, Yb(III) et néodyme, Nd(III), ouvrant ainsi la voie à la luminescence[8].
Les émissions provenant des ions lanthanides seuls ont des très faibles coefficients d'absorptions molaires, ce qui rend leurs propriétés de luminescence difficiles à observer[14]. En créant des complexes avec des ligands organiques comme le TTF, on peut accroître leur capacité d'absorption. En effet, le ligand utilisé est un TTF fonctionnalisé comme meilleur électro-accepteur, qui pourra absorber des photons et transmettre son énergie à l’ion lanthanide par effet-antenne, provoquant une émission dans le visible[8].
L’excitation du ligand TTF présente un défi, puisque l'énergie nécessaire correspond à des photons dans l’UV ou le visible, qui seront absorbés par le milieu. Pour contourner ce problème, on réalise une double émission de 2 photons dans l’infrarouge, qui ne seront pas absorbés par le milieu, et dont la somme des énergies permet l’excitation du ligand[14].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) F. Wudl, M. L. Kaplan, E. J. Hufnagel et E. W. Southwick, Jr., « A Convenient Synthesis of 1,4,5,8-Tetrahydro- 1,4,5,8-tetrathiafulvalene », The Journal of Organic Chemistry, vol. 39, no 25, , p. 3608-3609 (lire en ligne)
- « Tetrathiafulvalene », sur http://www.nist.gov/ (consulté le )
- « Tétrathiafulvalène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) Jiří Janoušek, Jiří Rybáček, Miloš Buděšínský et Lubomír Pospíšil, « Electrochemistry of Tetrathiafulvalene Ligands Assembled on the Surface of Gold Nanoparticles », Molecules, vol. 27, no 21, , p. 7639 (ISSN 1420-3049, DOI 10.3390/molecules27217639, lire en ligne, consulté le )
- (en) M. Bendikov, F. Wudl, D. F. Perepichka, « Tetrathiafulvalenes, Oligoacenenes, and Their Buckminsterfullerene Derivatives: The Brick and Mortar of Organic Electronics », Chemical Reviews, vol. 104, , p. 4891–4945 (DOI 10.1021/cr030666m)
- (en) Fabrice Pointillart, Boris le Guennic, Olivier Cador et Olivier Maury, « Lanthanide Ion and Tetrathiafulvalene-Based Ligand as a “Magic” Couple toward Luminescence, Single Molecule Magnets, and Magnetostructural Correlations », Accounts of Chemical Research, vol. 48, no 11, , p. 2834–2842 (ISSN 0001-4842 et 1520-4898, DOI 10.1021/acs.accounts.5b00296, lire en ligne, consulté le )
- « Ions lanthanide et ligands à cœur tétrathiofulvalène pour l’élaboration de molécules magnétiques et luminescentes - p28 - N°402 - L'Actualité Chimique, le journal de la SCF », sur Société Chimique de France (SCF) (consulté le )
- (en) Wudl, F.; Kaplan, M. L., « 2,2'Bi-1,3-dithiolylidene (Tetrathiafulvalene, TTF) and Its Radical Cation Derivatives », Inorg. Synth., vol. 19, , p. 27–30 (DOI 10.1002/9780470132500.ch7)
- (en) Ronald L. Meline et Ronald L. Elsenbaumer, « An expedient, cost effective large scale synthesis of tetrathiafulvalene », Journal of the Chemical Society, Perkin Transactions 1, no 16, , p. 2467–2470 (ISSN 1364-5463, DOI 10.1039/A805226C, lire en ligne, consulté le )
- (en) Adrian J. Moore et Martin R. Bryce, « Tetrathiafulvalene: A Convenient Large-Scale (20 g) Synthesis », Synthesis, vol. 1997, no 4, , p. 407–409 (ISSN 0039-7881 et 1437-210X, DOI 10.1055/s-1997-1209, lire en ligne, consulté le )
- José L. Segura et Nazario Martín, « New Concepts in Tetrathiafulvalene Chemistry », Angewandte Chemie (International Ed. in English), vol. 40, no 8, , p. 1372–1409 (ISSN 1521-3773, PMID 11317287, DOI 10.1002/1521-3773(20010417)40:8<1372::aid-anie1372>3.0.co;2-i, lire en ligne, consulté le )
- (en) Sophie Wenger, Pierre-Antoine Bouit, Qianli Chen et Joël Teuscher, « Efficient Electron Transfer and Sensitizer Regeneration in Stable π-Extended Tetrathiafulvalene-Sensitized Solar Cells », Journal of the American Chemical Society, vol. 132, no 14, , p. 5164–5169 (ISSN 0002-7863 et 1520-5126, DOI 10.1021/ja909291h, lire en ligne, consulté le )
- Ngoc Anh Thy Bui, « Luminescence de complexes de lanthanide par effet d'antenne à deux photons : vers l'imagerie fonctionnelle », École Doctorale de Chimie (thèses), Université de Lyon, (lire en ligne, consulté le )
Articles liés
- Électronique moléculaire
- TCNQ – Tétracyanoquinodiméthane
