Tétrafluorure de titane
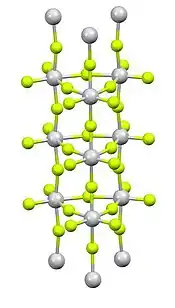
Le tétrafluorure de titane est un composé chimique de formule TiF4. Il se présente sous la forme d'une poudre blanche formée de cristaux incolores très hygroscopiques qui réagit avec l'eau en sifflant[1]. Sa structure cristalline en colonnes lui est propre : elle est constituée d'octaèdres TiF6 formant une structure orthorhombique du groupe d'espace Pnma (no 62) avec a = 2 281,1 pm, b = 384,4 pm, c = 956,8 pm, et Z = 12[4].
| Tétrafluorure de titane | |||
| |||
| __ Ti4+ __ F− Structure cristalline du tétrafluorure de titane |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | tétrafluorotitane | ||
| Nom systématique | Fluorure de titane(IV) | ||
| No CAS | |||
| No ECHA | 100.029.106 | ||
| No CE | 232-017-6 | ||
| PubChem | 121824 | ||
| SMILES | |||
| InChI | |||
| Apparence | solide incolore[1] | ||
| Propriétés chimiques | |||
| Formule | TiF4 | ||
| Masse molaire[2] | 123,861 ± 0,001 g/mol F 61,35 %, Ti 38,65 %, |
||
| Propriétés physiques | |||
| Masse volumique | 2,798 g·cm-3[3] à 25 °C | ||
| Cristallographie | |||
| Système cristallin | Orthorhombique | ||
| Classe cristalline ou groupe d’espace | Pnma (no 62) [4] |
||
| Paramètres de maille | a = 2 281,1 pm, b = 384,4 pm, c = 956,8 pm, et Z = 12[4] | ||
| Précautions | |||
| SGH[5] | |||
  Danger |
|||
| NFPA 704[5] | |||
| Transport[5] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
On peut obtenir du tétrafluorure de titane en faisant réagir du tétrachlorure de titane TiCl4 avec un excès de fluorure d'hydrogène HF[4] :
Le tétraflurorue de titane est utilisé pour la production de fluorures d'hétérosides, ou encore pour l'addition de carbanions aux aldéhydes et aux imines. Il est également employé comme catalyseur pour la synthèse chimiosélective et la déprotection des diacétates géminés d'aldéhydes. Son utilisation dans les dentifrices a également été étudiée[6].
Notes et références
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. II, Ferdinand Enke, Stuttgart 1978, p. 1343. (ISBN 3-432-87813-3)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Titanium(IV) fluoride, consultée le 10 février 2021.
- (de) H. Bialowons, M. Müller et B. G. Müller, « Titantetrafluorid – Eine überraschend einfache Kolumnarstruktur », Zeitschrift für anorganische und allgemeine Chemie, vol. 621, no 7, , p. 1227-1231 (DOI 10.1002/zaac.19956210720, lire en ligne)
- « Fiche du composé Titanium(IV) fluoride, 98% », sur Alfa Aesar (consulté le ).
- (en) N. Schlueter, C. Ganss, U. Mueller et J. Klimek, « Effect of Titanium Tetrafluoride and Sodium Fluoride on Erosion Progression in Enamel and Dentine in vitro », Caries Research, vol. 41, no 2, , p. 141-145 (PMID 17284916, DOI 10.1159/000098048, lire en ligne)




