Structure diamant
Un cristal de type diamant est une forme dérivée du cristal cubique à faces centrées (CFC). La structure ressemble à la structure blende, mais tous les sites atomiques sont identiques dans la structure diamant.
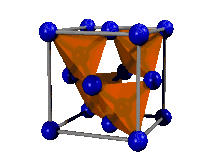
Il peut se décrire de différentes façons, notamment :
- soit comme deux mailles identiques d'un cristal de type CFC enchevêtrées, décalées d'un vecteur (1/4 ; 1/4 ; 1/4)·a, où a est le paramètre de maille. En d'autres termes, un cristal dont le système cristallin est CFC, mais dont le motif n'est pas un atome seul, mais deux atomes identiques séparés par un vecteur (1/4 ; 1/4 ; 1/4)·a.
- soit comme la maille d'un cristal CFC dont quatre des huit sites tétraédriques sont occupés, deux dans la moitié basse du cube, suivant une petite diagonale, et deux dans la moitié haute, suivant l'autre petite diagonale. Un site tétraédrique d'une maille CFC est le centre du tétraèdre formé par un atome au coin du cube, et les trois atomes au centre de chacune des faces se rejoignant dans ce même coin.
Pour résumer, un cristal de type diamant comporte un atome :
- aux 8 sommets d'un cube ;
- au centre de chacune des faces de ce cube ;
- dans quatre des huit sites tétraédriques du cube, c'est-à-dire au centre du tétraèdre formé par un coin du cube et les trois atomes au centre des trois faces adjacentes à ce coin.
Cristal de type « diamant »
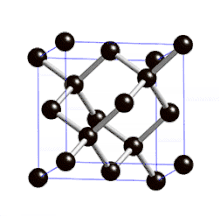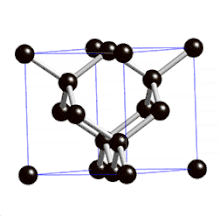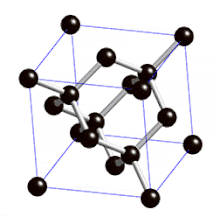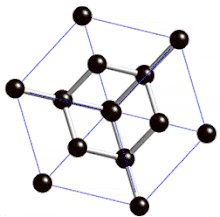
Définition
On parle de cristal type « diamant » lorsque tous les atomes qui composent la maille sont identiques. Les semi-conducteurs comme le silicium ou le germanium ont une structure de type « diamant ». C'est aussi le cas pour le zinc type-α, l'étain gris (forme α, qui n'est plus métallique mais semi-conductrice), et bien entendu pour le carbone diamant.
Nombre d'atomes par maille
La structure cristalline de type « diamant » comporte donc :
- 8 atomes aux coins, partagés par 8 mailles et qui comptent donc pour 1/8, soit au total (1/8)x8 = 1 atome pour la maille ;
- 6 atomes au centre des 6 faces, partagés par 2 mailles et qui comptent pour 1/2, soit au total (1/2)x6 = 3 atomes pour la maille ;
- 4 atomes à l'intérieur du cube et donc de la maille, dans 4 des 8 sites tétraédriques qui comptent pour 1, soit au total 1x4 = 4 atomes pour la maille.
La structure de type diamant compte donc 8 atomes par maille (contre quatre pour une structure de type cubique faces centrées classique).
Paramètre de maille
Dans le modèle des sphères dures, la distance de contact est celle entre un atome de coin et celui d'un site tétraédrique. Si on considère a, le paramètre de maille (la longueur de l'arête du cube), la grande diagonale du cube vaut donc , et la distance de contact (c'est-à-dire la distance entre les centres des deux atomes en contact, soit 2R, où R est le rayon atomique) vaut un quart de cette valeur ; on a donc :
On en déduit donc le paramètre de maille est:
Compacité
La compacité du cristal type diamant est de :
ce qui en fait un empilement très peu compact (à titre de comparaison, la compacité d'une maille CFC classique est d'environ 0,74).
Cristal de type « blende »
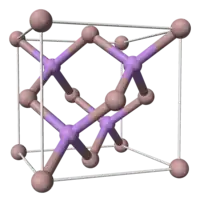
On parle de cristal de type « blende » pour des cristaux de même structure que le diamant, mais composés de deux types d'atomes différents. Ainsi la maille comporte deux types d'atomes différents : les atomes qui composent la maille CFC étant d'une sorte, les quatre atomes dans les sites tétraédriques de l'autre sorte, ce qui fait que chaque atome est lié à 4 voisins de nature différente de la sienne.
C'est le cas de la sphalérite (ZnS - nom actuel de la blende), et de la plupart des composés de type I-VII, II-VI (CdS, ZnSe, CdSe, CdTe, ZnTe, BeTe...), III-V (GaAs, AlAs, InP...) ou d'alliage de silicium (silicium-germanium, carbure de silicium type-β), dont la plupart sont des semi-conducteurs.
La substitution ordonnée de deux atomes de la même espèce chimique (carbone dans le cas du diamant) par deux atomes d'espèce différente (zinc et soufre dans le cas de la sphalérite) a comme résultat une baisse de symétrie, de Fd3m à F43m.



