Streptavidine
La streptavidine est une protéine de 52,8 kDa purifiée à partir de la bactérie Streptomyces avidinii. Les homo-tétramères de streptavidine ont une affinité exceptionnellement haute pour la biotine (également appelée vitamine B7, B8 ou H selon les nomenclatures). Ainsi, avec une constante de dissociation (Kd) de l'ordre de 10−14 mol/L[1], la liaison non covalente de la biotine à la streptavidine est l'une des plus fortes interactions connues dans la nature. La streptavidine est très utilisée en biologie moléculaire et bionanotechnologie en raison de la résistance du complexe streptavidine-biotine aux solvants organiques, dénaturants (ex : chlorure de guanidinium), détergents (ex : SDS, Triton), enzymes protéolytiques et températures et pH extrêmes.
| Streptavidine | ||
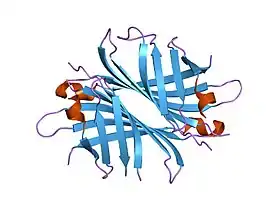 Représentation graphique de la streptavidine (1pts) | ||
| Caractéristiques générales | ||
|---|---|---|
| Streptomyces avidinii | ||
Structure
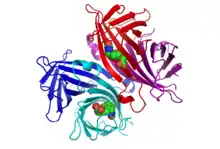
La structure du cristal de strepatavidine liée à la biotine a été publiée par deux équipes en 1989. La structure a pu être déterminée en utilisant des techniques de diffractions anomales multiples par Hendrickson et al.[2] à l'université Columbia, et en utilisant la technique de remplacement isomorphe multiple par Weber et al.[3] à l'E. I. DuPont Central Research and Developpement Department. Depuis , 135 structures sont déposées dans la Protein Data Bank. Les extrémités N et C-terminales de la protéine native de 159 résidus sont excisés afin de donner une streptavidine plus courte, habituellement composée des résidus 13 à 139. Cette modification est nécessaire à l'obtention de la haute affinité avec la biotine. La structure secondaire du monomère de streptavidine est composée de 8 feuillets bêta antiparallèles qui se replient pour obtenir une structure tertiaire de tonneau bêta antiparallèle. Un site de liaison à la biotine est situé au bout de chaque tonneau bêta. Quatre monomères identiques de streptavidine s'associent pour donner la structure quaternaire tétramérique de la streptavidine. Le site de liaison à la biotine de chaque tonneau bêta est constitué de résidus situés à l'intérieur du tonneau associés à un résidu conservé Trp120 de la sous-unité voisine. De cette manière, chaque sous-unité contribue au site de liaison de la sous-unité voisine, le tétramère pouvant être considéré comme un dimère de dimères fonctionnels.
Origines de la haute affinité à la biotine
Les nombreuses structures cristallographiques du complexe streptavidine-biotine ont mis en lumière la remarquable affinité existant entre ces deux composés. D'abord, il existe une forte complémentarité conformationnelle entre la poche de liaison de la streptavidine et la biotine. Ensuite, lors de la liaison entre les deux molécules, un important réseau de liaisons hydrogène se forme. Ainsi, il existe 8 liaisons hydrogène créées directement à partir des résidus de la poche de liaison formant une première couche et impliquant les résidus Asn23, Tyr43, Ser27, Ser45, Asn49, Ser88, Thr90 and Asp128. Il existe également une seconde couche de liaisons hydrogène impliquant les résidus interagissant avec les résidus à l'origine de la première couche. Cependant, l'affinité streptavidine-biotine dépasse effectivement les prédictions faites à partir de la connaissance de ces liaisons hydrogène seules suggérant l’existence d'un autre mécanisme contribuant à cette haute affinité[4]. La poche de liaison à la biotine est de nature hydrophobe et il existe de nombreuses interactions et contacts hydrophobes médiés par la force de van der Waals lorsque la biotine se trouve dans la poche de liaison, ces éléments pouvant participer à la forte affinité. Cette hypothèse est renforcée par l'existence de résidus tryptophane conservés au niveau de la poche. Enfin, la liaison de la biotine est accompagnée par la stabilisation d'une boucle flexible reliant les feuillets bêta 3 et 4 verrouillant la biotine dans la poche de liaison comme une ceinture et contribuant à l'extrême lenteur du taux de dissociation de la biotine.
La plupart des tentatives de modification de la streptavidine ont abouti à une diminution de l'affinité avec la biotine ce qui est prévisible considérant le niveau d'optimisation du système de liaison. Cependant, un mutant récent de streptavidine nommé traptavidine a montré une dissociation de la biotine 10 fois inférieure à l'originale, ainsi qu'une stabilité thermique et mécanique augmentées[5]. Cette diminution de dissociation s'accompagne d'une diminution par 2 du taux d'association. Cette protéine est distribuée par le département de biochimie de l'université d'Oxford.
Utilisation en biotechnologies
Parmi les utilisations les plus communes de la protéine, on retrouve la purification ou la détection de diverses biomolécules. Le fort lien streptavidine-biotine peut être utilisé afin d'attacher diverses biomolécules l'une à l'autre ou sur un support solide. Des conditions sévères sont nécessaires à la cassure du lien streptavidine-biotine dénaturant souvent la protéine d’intérêt en cours de purification. Cependant, il a été montré qu'une courte incubation dans de l'eau à au moins 70 °C peut casser l'interaction de manière réversible et sans dénaturer la streptavidine, permettant une réutilisation de la protéine sur un support solide[6]. Une autre application baptisée Strep-tag est un système optimisé pour la purification et la détection de protéines. La streptavidine est largement utilisée dans des expériences de Western blot ou immuno-enzymatiques, conjuguée à des molécules rapportrices telles que la peroxydase de raifort. La streptavidine a également été utilisée au cours du développement des nanobiotechnologies, l'utilisation de molécules biologiques telles que les protéines ou les lipides étant nécessaire à la création de structures à l'échelle nanométrique. Dans ce contexte, la streptavidine peut être utilisée comme une brique afin de lier des molécules d'ADN biotinylées pour créer des échafaudages de nanotubes à paroi de carbone[7] ou encore des complexes d'ADN polyédriques[8]. La streptavidine tétramérique a également été utilisée comme un point de fixation autour duquel d'autres protéines peuvent être arrangées, soit par tag d'affinité tel que dans les méthodes Strep-tag ou Avitag, ou par fusion génétique de type SpyTag[9].
- Immunothérapie pré-ciblée
L'immunothérapie pré-ciblée utilise la streptavidine conjuguée à un anticorps monoclonal contre un antigène spécifique de cellule cancéreuse suivi d'une injection de biotine radiomarquée afin de délivrer une radiation à la seule cellule cancéreuse. Les premiers écueils impliquent la saturation de la streptavidine par la biotine endogène et un fort taux d'exposition radioactive des reins en raison de la forte capacité de la streptavidine à s'adsorber sur les cellules. Il est actuellement supposé que cette propriété à se lier aux cellules adhérentes telles que les plaquettes activées ou les mélanomes résulte d'une liaison à l'intégrine médiée par la séquence RYD de la streptavidine[10].
Variantes à nombre contrôlé de sites de liaison à la biotine
- Streptavidine monovalente vs streptavidine monomérique
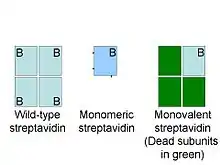
La streptavidine est un tétramère et chaque sous-unité lie la biotine avec une affinité égale. La multivalence est un avantage pour certaines applications, par exemple lorsque l'effet d'avidité améliore la capacité des molécules liées à la streptavidine à détecter des cellules T spécifiques[11]. Dans d'autres cas, tel que l'utilisation de streptavidine pour l'imagerie de protéines spécifiques dans les cellules, la multivalence peut perturber le fonctionnement de la protéine d'intérêt. La streptavidine monovalente est une forme recombinante de streptavidine tétramérique avec un unique site de liaison à la biotine fonctionnel. Ce site a une affinité de 10−14 mol/L et ne peut pas causer de liaison non spécifique[12]. Cette protéine est distribuée par l'université d'Oxford. Les applications de cette protéine incluent le suivi fluorescent de récepteur de surface cellulaires, l'identification de régions pour la cryomicroscopie électronique, la décoration d'origami ADN.
La streptavidine monomérique est une forme recombinante de streptavidine incluant des mutations cassant le tétramère en un monomère permettant d’augmenter la solubilité de la sous-unité ainsi isolée. Les différentes versions de streptavidine monomérique ont une affinité de 10−7 mol/L 10−8 mol/L et ne sont donc pas idéale pour des applications de marquage mais sont utiles pour la purification, situation dans laquelle la réversibilité de la liaison est souhaitable[13] - [14].
- Strepatavidine divalente définie
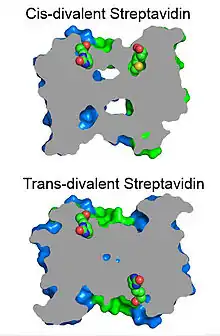
Une streptavidine avec exactement deux sites de liaison à la biotine peut être produite en mélangeant des sous-unités avec et sans site de liaison fonctionnel puis par purification par chromatographie à échange d'ions. Les sites fonctionnels ont la même stabilité de liaison à la biotine que la streptavidine sauvage. Les streptavidines divalentes présentant deux sites de liaison fonctionnels réunis (cis-divalente) ou séparés (trans-divalente) peuvent être purifiées séparément[15].
Comparaison avec l'avidine
La streptavidine n'est pas la seule protéine capable de lier la biotine avec une forte affinité. L'avidine est notablement capable de lier la biotine avec une forte affinité. Originellement isolée du blanc d’œuf, l'avidine ne présente que 30% d'homologie avec la streptavidine, mais des structures secondaire, tertiaire et quaternaire quasiment identiques. Elle a une affinité plus forte pour la biotine (Kd ~ 10−15 M) mais est glycosylée, chargée positivement, possède une activité pseudo-catalytique (elle peut favoriser l'hydrolyse alcaline d'une liaison ester entre la biotine et un groupement nitrophénol) et possède une plus forte tendance à l’agrégation. De plus, la streptavidine se lie mieux aux conjugués de biotine. L'avidine possède une affinité plus basse que la streptavidine quand la biotine est conjuguée à une autre molécule, ceci malgré une affinité plus forte pour la biotine libre.
La streptavidine a un point isoélectrique autour de 5 (bien qu'une forme recombinante avec un point isoélectrique neutre soit commercialement disponible). En raison de l'absence de sucre et de ce point isoélectrique proche de la neutralité, la streptavidine a l'avantage de créer bien moins de liaisons non spécifiques que l'avidine. L'avidine déglycosylée (NeutrAvidin) est plus comparable à la streptavidine concernant la taille, le point isoélectrique et les liaisons non spécifiques.
Références
- Green, NM (1975).
- Hendrickson, W. A. (1989).
- Weber, P. C. (1989).
- DeChancie, Jason; Houk, K. N. (2007).
- Chivers, Claire E; Crozat, Estelle; Chu, Calvin; Moy, Vincent T; Sherratt, David J; Howarth, Mark (2010).
- Holmberg, Anders; Blomstergren, Anna; Nord, Olof; Lukacs, Morten; Lundeberg, Joakim; Uhlén, Mathias (2005).
- Osojic, GN; Hersam, MC (2012).
- Zhang, C; Tian, C; Guo, F; Liu, Z; Jiang, W; Mao, C (2012).
- Fairhead, M; Veggiani, G et al. (2014).
- Alon, R; Bayer, EA; Wilchek, M (1992).
- Xu, X; Screaton, GR (2002).
- Howarth, Mark; Chinnapen, Daniel J-F; Gerrow, Kimberly; Dorrestein, Pieter C; Grandy, Melanie R; Kelleher, Neil L; El-Husseini, Alaa; Ting, Alice Y (2006).
- Wu, S.-C.; Wong, SL (2005).
- Lim, K (2011).
- Fairhead, M. et al. (2013).