Spectrométrie de masse en tandem quadripôle-temps de vol
La spectrométrie de masse en tandem quadripôle-temps de vol (QqTOF) est une technique de détection en spectrométrie de masse permettant de détecter et d’identifier des molécules par mesure de leur rapport masse sur charge (m/z). C’est un spectromètre de masse hybride : c’est le couplage d’un analyseur quadripolaire, qui mesure le rapport m/z des ions par la transmission des ions qui traversent un champ électrostatique, et d’un analyseur à temps de vol, qui mesure le rapport m/z des ions par la séparation dans le temps à partir de la vitesse des ions. Le premier quadripôle procure une grande efficacité au processus MS/MS. Le temps de vol (TOF), quant à lui, apporte à sa grande sensibilité, sa grande rapidité d’analyse et ses résolutions et précision en masse bien meilleure sur les ions produits par la cellule de collision que la configuration d’un spectromètre de type triple quadripôle. Par contre, comparé au triple quadripôle, les spectromètres de masse en tandem de type QqTOF sont limités par la faible gamme dynamique du TOF.
Histoire
La spectrométrie de masse en tandem quadripôle-temps de vol a été commercialisée pour la première fois vers 1995. Les spectromètres de masse de type QqTOF, robustes, puissants et possédant des capacités uniques, ont, depuis, été adoptés par la communauté de la chimie analytique[1].
Principe de fonctionnement
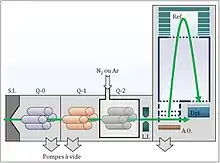
Pour analyser des composés, il faut d’abord transformer les analytes en ions dans la phase gazeuse. Les spectromètres de masse sont munis d’une source d’ions, d’analyseurs de masse, d’un détecteur et d’un système de traitement des données[2]. Dans un spectromètre de masse en tandem quadripôle-temps de vol, les ions produits par la source d’ions passent au travers d’un quadripôle, puis d’une cellule de collision et sont canalisés vers un détecteur à temps de vol. Le QqTOF peut être décrit comme un triple quadripôle où le dernier quadripôle a été remplacé par un analyseur à temps de vol[1]. Pour l’analyse de masse en tandem (MS/MS), les ions doivent être produits par une source d’ions. La source d’ions, dans le cas d’un spectromètre de masse en tandem quadripôle-temps de vol, est généralement basée sur la désorption-ionisation laser assistée par matrice (MALDI), l’ionisation chimique à pression atmosphérique (APCI) ou une source d’Ionisation par électronébuliseur (ESI)[3] - [1].
Les ions produits sont guidés par le quadripôle 0 vers le premier analyseur de masse, le quadripôle 1. Le quadripôle 0 est utilisé pour le refroidissement et la focalisation des ions entrant dans l’instrument[1]. Le quadripôle 1 est opéré dans le mode constant, pour laisser passer seulement les ions d’intérêt mais ceci peut changer si on utilise le mode ms/ms. Dans le mode ms/ms, le quadripôle 1 produit un champ électrostatique qui stabilise la trajectoire des ions qui ont un rapport m/z précis. Les autres ions ayant un rapport m/z différent sont déstabilisés et éjectés à l’extérieur du quadripôle.
Les ions ainsi sélectionnés entrent ensuite dans la cellule à collisions où ils subissent des collisions avec un gaz inerte comme l’azote (N2) ou l’argon (Ar), ce qui mène à leur dissociation. Les ions produits résultants et les ions précurseurs non fractionnés sont concentrés vers la dernière section du spectromètre de masse à l’aide de lentilles ioniques. Dans le mode ms la cellule de collision ne fait que transmettre les ions vers le e TOF.
Le jet continu d’ions se dirige vers l’accélérateur orthogonal où une impulsion électrique pousse les ions perpendiculairement à leur trajectoire originale. Les ions se retrouvent alors dans une région où aucun champ électrostatique n’est appliqué et c’est à cet endroit que la séparation par temps de vol se produit. Les ions entrent ensuite dans un miroir à ions ou réflectron qui est composé d’une série d’anneaux ayant des voltages croissants. Cette partie de l’analyseur sert à corriger les différences de temps de vol d’ions de même rapport m/z causées par des variations d’énergie cinétique. Cela a pour effet de diminuer la dispersion temporelle des ions de même rapport m/z et ainsi augmenter la résolution du spectre qui sera obtenu[2]. Les ions sont ensuite dirigés vers le détecteur qui génère un signal électrique lorsque les ions frappent sa surface. Ce signal est ensuite amplifié, traité et finalement envoyé à un ordinateur pour affichage.
Applications
Le QqTOF est un instrument qui peut être utilisé avec plusieurs sources d’ionisation comme le MALDI ou le ESI. La désorption-ionisation laser assistée par matrice (MALDI) est un ioniseur souvent utilisé, en général pour l’analyse de peptides ou de protéines. Utilisé avec le spectromètre de masse quadripôle-temps de vol, il devient un outil très important pour ces analyses. Après avoir été ionisés par le MALDI, les particules de l’échantillon doivent traverser le quadripôle qui permet une sélection des ions analytes intéressants et ensuite le temps de vol permet de séparer les ions par le temps qu’ils prennent. Cet instrument est très utilisé pour des mesures qualitatives comme pour la détermination d’une protéine inconnue. Une protéine peut être facilement identifiée lorsque l’on compare la combinaison des peptides identifiés par l’analyse avec celles d’une banque de données[4]. Une grande exactitude sur la masse et une haute résolution sont des caractéristiques importantes de la spectrométrie de masse en tandem et l’une des raisons pour lesquelles l’utilisation du QqTOF devient de plus en plus répandue[5]. De plus, puisque le MALDI utilise une plaque métallique où sont déposés la matrice et les analytes, le QqTOF est très utilisé avec cette source d’ions pour analyser des molécules organiques comme des protéines. Cette plaque peut prendre plusieurs substances que l’on peut ensuite faire analyser par l’instrument sans avoir à modifier ses réglages et son étalonnage. Cela signifie que l’on peut analyser plusieurs analytes dans des matrices différentes sans inconvénients et de manière plus efficace[1].
Si l’analyte est ionisable, le QqTOF est très utilisé dans l’analyse de résidus organiques et peut être adapté à l’analyse de petites molécules de moins de 1000 Da, ou de macromolécules telles que des biopolymères, polymères et autre. L’analyse de résidus consiste à vérifier la présence de composés organiques autres que celles qu’indiquées pour éviter des allergies ou des contaminations. Le QqTOF n’est pas uniquement jumelé avec le MALDI, il peut également être couplé avec un HPLC-ESI[6]. Le HPLC-ESI-QTOF est un instrument qui procède à une chromatographie en phase liquide pour séparer les analytes. Leur séparation est déterminée par leur temps de rétention qui est déterminé par leur affinité avec la colonne qu’ils traversent. Ensuite, les analytes sont nébulisés par la source d’ions ESI, puis sont introduits dans le QqTOF où la sélection d’ions et l’analyse des ions sélectionnés est produite. Cet instrument est utilisé pour la caractérisation d’analytes. Il a, entre autres, été utilisé pour caractériser de façon approfondie les composés aromatiques dans les feuilles d’olivier, dans une matrice d’éthanol, ou dans l’eau[7].
Le QqTOF est également utilisé pour des mesures quantitatives. En combinant le QqTOF avec la chromatographie liquide (LC), il est possible d’analyser de manière quantitative les pesticides dans l’eau. Par contre, la performance de l’appareil pour des données quantitatives est moins bonne que celle d’autres technologies déjà présentes et moins coûteuses. La matrice utilisée pour cette analyse peut être de l’eau ou de la nourriture. Le LC-QqTOF a plusieurs applications reliées au domaine de l’alimentation et de la santé telles que l’identification de substances qui peuvent dégrader les pesticides, l’identification de métabolites et le balayage de pesticides non ciblés. L’identification de substances dégradantes est importante parce que les pesticides dégradés peuvent posséder des propriétés toxiques. En santé, le potentiel toxique ou dangereux de certains métabolites rend leur caractérisation très importante. Le balayage de pesticides non ciblés est utilisé pour les compagnies qui veulent tester certains pesticides pouvant être présent dans leurs produits[8].
Le QqTOF couplé avec la chromatographie liquide ultra performance (UPLC) permet d’effectuer l’analyse de résidus de produits pharmaceutiques dans les égouts. Ces résidus sont souvent acides ou neutres. La matrice pour ce type de mesure est l’eau rejetée par les compagnies pharmaceutiques. Les concentrations en résidus pharmaceutiques dans l’eau sont parfois trop faibles pour en faire l’analyse sans préparer l’échantillon. Alors, avant de procéder à l’analyse, une extraction est nécessaire pour concentrer l’analyte[9].
Limitations
Le QqTOF est l’un des instruments les plus polyvalents actuellement présents sur le marché. Il présente cependant certaines limitations. L’une des limitations du QqTOF est la taille des molécules et des ions à analyser. Le QqTOF ne peut pas offrir la même précision sur la masse avec des molécules de grande taille par rapport à celles de plus petite taille. Cela est causé par la différence de vélocité entre les deux. Un QqTOF possède une cellule de collision dans laquelle les ions sont dans un environnement où la pression est réduite et où ils s'entrechoquent avec des particules inertes comme de l’azote ou de l’argon. La vitesse moyenne d’une particule inerte est de 475 m/s et la vitesse de la plupart des petites molécules est très semblable (entre 470 et 475 m/s). Une plus grosse particule, dont la taille excède 20 kDa, a une quantité de mouvement trop petite ce qui fait en sorte que son passage dans la cellule de collision est beaucoup plus long et, ainsi, la grosse particule reçoit beaucoup plus de collisions qu’une petite molécule. Une molécule avec une masse de 650 kDa subit 1000 fois plus de collisions qu’une plus petite molécule. Lors d’une collision, les petites molécules ne sont pas vraiment affectées parce que la vitesse de la molécule et du gaz inerte sont à peu près les mêmes. Par contre, pour une grosse molécule, ces collisions sont très efficaces et peuvent pousser la molécule hors de sa trajectoire[10]. Une molécule hors trajectoire signifie que moins de molécules passe dans le TOF donc, moins d’ions vont être analysés et le signal observé à l’ordinateur est donc plus faible.

Une autre des principales limitations de l’instrument est la vitesse initiale de l’analyte lorsqu’il est introduit dans l’appareil. Au moment de l’injection, le mouvement brownien implique que les particules peuvent aller dans n’importe quelle direction ; la vitesse initiale d'une particule peut donc être opposée au sens de l’instrument. Une fois à l’intérieur des champs électrostatique de l’instrument, ce genre de particules voit sa vitesse dans la « mauvaise » direction diminuer et accélère pour aller dans la bonne direction (Figure 2, 2.). Cet évènement, également appelé le « turn around time », a pour conséquence que pour deux molécules possédant les mêmes caractéristiques, l’une d’entre elles peut aller de la direction opposée au trajet prévu et revenir ensuite. Le temps pris par la particule pour effectuer ce détour avant de se déplacer dans la bonne direction génère un délai, de sorte qu’au moment de détecter la molécule, le pic obtenu est plus large qu’il ne le devrait (Figure 2, 3). L’élargissement des pics est un problème puisque cela peut diminuer la résolution de l’instrument[1]. Cela est un problème dans le mode MS/MS mais pas dans le mode MS, puisque la haute résolution du TOF permet une séparation suffisante. Par contre, en MS/MS on ne peut pas savoir à quel analyte correspond chaque pic du spectre puisque les spectres sont superposés.
Une autre limitation du QqTOF est que lorsqu’il est couplé avec la chromatographie liquide pour des analyses quantitative de pesticides dans l’eau, le quadripôle n’a pas assez de résolution pour faire des déterminations et des identifications. Lorsque la matrice de l’analyse est trop complexe ou que plus qu’un analyte est présent dans la solution, le quadripôle n’a pas assez de précision pour pouvoir séparer tous les analytes. Vu que le quadripôle sert de sélectionneur pour ensuite faire l’analyse avec le TOF et le MS, cela implique que les ions dirigés vers le TOF ne sont pas nécessairement que les ions désirés[1].
Comparaison avec un triple quadripôle (QqQ)
Une étude a été effectuée pour comparer un spectromètre de masse de type triple quadripôle (QqQ) à un spectromètre de masse de type quadripôle-temps de vol (QqTOF). Dans des conditions expérimentales semblables, l’étude a démontré que le système quadripôle-temps de vol était jusqu’à cinq fois plus précis que l’instrument à triple quadripôle. De plus, la sélectivité du balayage des ions précurseurs est meilleure pour le QqTOF grâce à la grande résolution que le réflectron apporte au temps de vol. Les résultats de cette étude suggèrent que les instruments de type QqTOF sont plus performants que les instruments de type QqQ. Finalement, les spectromètres de masse quadripôle-temps de vol sont une alternative très viable aux triples quadripôles pour le balayage des ions précurseurs dans une expérience ms/ms, cela en combinant la haute sensibilité et sélectivité, autant pour des analyses de spectrométrie de masse simples qu’en tandem[11]. L'un des principaux avantages du QqTOF par rapport à un QqQ est la possibilité d’obtenir une exactitude sur la masse très bonne dans le mode balayage ou dans le mode balayage des ions produits. Cela permet d’obtenir des informations sur la composition de l’analyte. Le QqQ ne permet pas d’obtenir ce type d’information parce qu’il s'agit d'un analyseur hybride de base résolution. Ceci empêche la mesure des rapports masse sur charge avec une bonne exactitude sur la masse dans les matrices complexes.
Références
- (en) Igor V. Chernushevich, A. V., « An introduction to quadripole-time-of-flight mass spectrometry », Journal of Mass Spectrometry, vol. 36, , p. 849-865
- (en) Jürgen H Gross, Mass Spectrometry : A Textbook, Berlin, Allemagne, , 2e éd..
- (en) A.V. Loboda, A. K., « A tandem quadrupole/time-of-flight mass spectrometer (QqTOF) with a MALDI source: design and performance », Rapid Communications in Mass Spectrometry, vol. 14, no 12, , p. 1047-1057.
- (en) Henzel W. J., Watanabe C. Stults, J. T., « Protein identification: the origins of peptide mass fingerprinting », Journal of the American Society for Mass Spectrometry, vol. 14, no 9, , p. 931-942.
- (en) Yaoyang Zhang, B. R.-C., « Protein Analysis by Shotgun/Bottom-up Proteomics », American Chemical Society, vol. 133, no 4, , p. 2343-2394.
- (en) Jinchuan Yang, « Q-TOF MS and Residue Analysis, Technical Note », Waters, , p. 1-4.
- (en) Rosa Quirantes-Piné, J. L.-S.-C.-G., « HPLC-ESI-QTOF-MS as a Powerful Analytical Tool for Characterising Phenolic Compounds in Olive-Leaf Extracts », Phytochemical Analysis, vol. 83, no 15, , p. 213-223.
- (en) Silvia Lacorte, A. R.-A., « Time of flight mass spectrometry applied to the liquid chromatographic analysis of pesticides in water and food », Mass Spectrometry Reviews, vol. 25, no 6, , p. 866-880.
- (en) Martin Lavén, T. A-E., « Serial mixed-mode cation- and anion-exchange solid-phase extraction for separation of basic, neutral and acidic pharmaceuticals in wastewater and analysis by high-performance liquid chromatography–quadrupole time-of-flight mass spectrometry. », Journal of Chromatography A, vol. 1216, no 1, , p. 49-62.
- (en) Reilley, J. L., « Limitation of Time-of-Flight Resolution in the Ultra High Mass Range », Analytical Chemistry, vol. 83, no 15, , p. 5831-5833.
- (en) Hanno Steen, B. K., « Quadrupole time-of-flight versus triple-quadrupole mass spectrometry for the determination of phosphopeptides by precursor ion scanning », Journal of Mass Spectrometry, vol. 36, , p. 782-790