Réarrangement de Bamberger
Le réarrangement de Bamberger est une réaction chimique se produisant entre les N-phénylhydroxylamines et les acides forts dans l'eau. Elle a pour effet la formation de 4-aminophénols[1] - [2]. Elle porte le nom du chimiste allemand Eugen Bamberger (1857–1932).
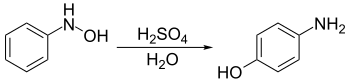
Le réarrangement de Bamberger.
Les N-phénylhydroxylamines sont généralement synthétisées à partir de nitrobenzènes au moyen d'une réaction d'oxydo-réduction, avec du rhodium[3] ou du zinc[4].
Mécanisme
Le mécanisme du réarrangement de Bamberger consiste tout d'abord en la protonation de la N-phenylhydroxylamine 1. La N-protonation 2 est alors favorisée, mais inefficace. La O-protonation 3 peut former l'ion nitrénium 4, lequel peut réagir avec les nucléophiles (H2O) pour former le 4-aminophénol désiré 5[5] - [6].
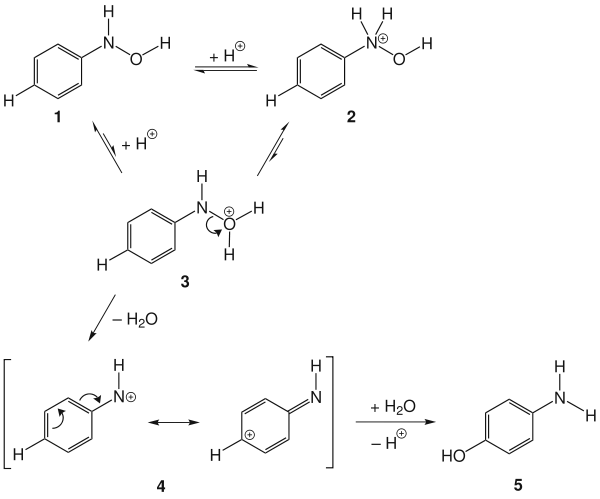
Mécanisme du réarrangement de Bamberger.
Références
- (en) E. Bamberger, « Uber das Phenylhydroxylamin », Chem. Ber., vol. 27, , p. 1347 & 1548–1557 (DOI 10.1002/cber.18940270276, lire en ligne [Abstract])
- (en) R. E. Harman, « Chloro-p-benzoquinone », Organic Syntheses, vol. 35, , p. 22 (lire en ligne) (also in the Collective Volume (1963) 4:148 (PDF)).
- (en) Oxley, P. W.; Adger, B. M.; Sasse, M. J.; Forth, M. A., « N-Acetyl-N-phenylhydroxylamine via Catalytic Transfer Hydrogenation of Nitrobenzene using Hydrazine and Rhodium on Carbon », Organic Syntheses, vol. 67, , p. 187 (lire en ligne) (également dans Collective Volume (1993) 8:16 (PDF)).
- (en) O. Kamm, « β-Phenylhydroxylamine », Organic Syntheses, vol. 4, , p. 57 (lire en ligne) (également dans Collective Volume (1941) 1:445 (PDF)).
- (en) Sone, Takaaki; Hamamoto, Kazuhiro; Seiji, Yoshiyuki; Shinkai, Seiji; Manabe, Osamu, « Kinetics and mechanisms of the Bamberger rearrangement. Part 4. Rearrangement of sterically hindered phenylhydroxylamines to 4-aminophenols in aqueous sulphuric acid solution », J. Chem. Soc. Perkin Trans. II, , p. 1596–1598 (DOI 10.1039/P29810000298)
- (en) George Kohnstam, W. Andrew Petch and D. Lyn H. Williams, « Kinetic substituent and isotope effects in the acid-catalysed rearrangement of N-phenylhydroxylamines. Are nitrenium lons involved? », J. Chem. Soc. Perkin Trans. II, , p. 423–427 (DOI 10.1039/P29840000423)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Bamberger rearrangement » (voir la liste des auteurs).
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.