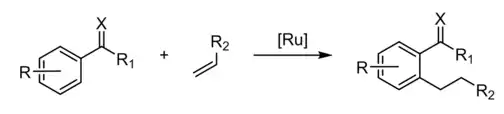
Réaction de Murai
La réaction de Murai est une réaction organique qui utilise l'activation de liaison C-H pour créer une nouvelle liaison C-C entre un alcène interne terminal ou contraint et un composé aromatique utilisant un catalyseur au ruthénium[1]. La réaction, nommée d'après Shinji Murai, a été rapportée pour la première fois en 1993. Bien qu'il ne s'agisse pas du premier exemple d'activation de liaison C-H, la réaction de Murai est remarquable pour son efficacité et son large spectre[2] - [3]. Les exemples précédents de telles hydroarylations (en) nécessitaient davantage de conditions de forçage et avaient une spécificité étroite[4].
Spécificité et régiochimie
La réaction a été démontrée initialement en utilisant une cétone comme groupe directeur (en), mais d'autres groupes fonctionnels ont été documentés, notamment des esters, des imines, des nitriles et des imidates[5]. Des réactions de Murai ont également été rapportées avec des alcynes disubstitués[6]. Des groupes directeurs bidentates permettent l'orthoalkylation de cycles aromatiques avec des cétones α,β-insaturées, généralement non réactives dans les réactions de Murai[7].
Les premières réactions de Murai réalisées ont été affectées par des produits secondaires d'alkylation aux deux positions ortho. Ce problème peut être partiellement résolu en utilisant un groupe protecteur orthométhyle. Malheureusement, avec les groupes orthométhyle, la vitesse et la complétion de la réaction sont réduites[3]. Des substituants à la position méta influencent la régiosélectivité[8]. La réaction ajoute de préférence au moins une position ortho stériquement encombrée, sauf lorsqu'il existe un groupe en position méta capable de se coordonner avec le catalyseur au ruthénium. Les méthoxyacétophénones présentent une réaction préférentielle dans la position la plus encombrée.

Mécanisme réactionnel
Une variété de catalyseurs au ruthénium catalysent la réaction de Murai, notamment le RuH2(CO)(PPh3)3, le RuH2(PPh3)4, le Ru(CO)2(PPh3)3 et le Ru3(CO)12[9].
Catalyseurs au Ru(0)
Le mécanisme détaillé de la réaction de Murai n'a pas été élucidé. Les études expérimentales et les simulations numériques montrent au moins deux mécanismes différents, en fonction du catalyseur[10] - [11]. Pour les catalyseurs tels que [Ru(H)2(CO)(PR3)3], qui sont actifs avec Ru0, une combinaison d'études fonctionnelles de densité et de résultats expérimentaux a conduit à proposer le mécanisme suivant[3] - [12] :
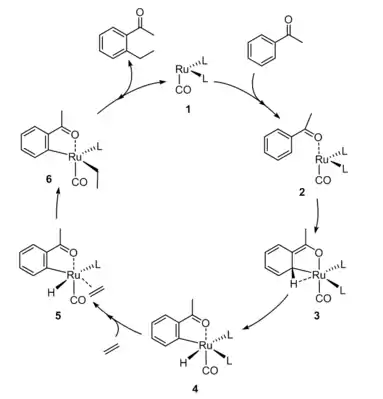
Il est possible que, à des températures élevées, le RuH2(CO)(PPh3)3 convertisse les espèces insaturées du Ru(CO)(PPh3)n[9]. Le cycle catalytique pourrait commencer par la coordination de la cétone suivie de l'addition oxydante d'une liaison C-H. Le métallacycle (en) pentacoordonné résultant est stabilisé par une interaction agostique. La formation de la liaison C-C est l’étape limitante du taux de conversion.
Catalyseurs au Ru(II)
Le complexe [Ru(o-C6H4PPh2)(H)(CO)(PPh3)2] catalyse la réaction de Murai à température ambiante[13] - [14] - [15]. Pour [Ru(H)2(H2)2(PR3)2], le complexe actif est [Ru(H)2(PR3)2].
_omitted_for_clarity.png.webp)
Une fois que la forme active du complexe de catalyseur au ruthénium est générée à partir de 1, l’acétophénone se coordonne vers le complexe via son oxygène carbonyle et de manière agostique via sa liaison C-H ortho (2). Comme dans le mécanisme proposé pour Ru0, cette interaction agostique conduit à l'addition oxydante du C-H ortho. L’élimination réductrice libère du H2, qui reste coordonné, ce qui donne le complexe 3. La coordination de l'éthylène et la décoordination de la cétone conduisent au complexe 4, qui subit ensuite une insertion migratoire d'éthylène dans l'hydrure pour donner 5. Après l'addition oxydative de H2 (6), le complexe élimine par réduction le produit pour donner le produit agostiquement lié au complexe. La coordination d’une autre molécule d’acétophénone régénère le complexe 2.
Références
- (en) Kakiuchi et Kochi, « Transition-Metal-Catalyzed Carbon-Carbon Bond Formation via Carbon-Hydrogen Bond Cleavage », Synthesis, vol. 2008, no 19, , p. 3013–3039 (ISSN 0039-7881, DOI 10.1055/s-2008-1067256)
- (en) Murai, Kakiuchi, Sekine et Tanaka, « Efficient catalytic addition of aromatic carbon-hydrogen bonds to olefins », Nature, vol. 366, no 6455, , p. 529–531 (DOI 10.1038/366529a0, Bibcode 1993Natur.366..529M)
- (en) Murai, Kakiuchi, Sekine et Tanaka, « Catalytic C-H/olefin coupling », Pure and Applied Chemistry, vol. 66, no 7, , p. 1527–1534 (ISSN 1365-3075, DOI 10.1351/pac199466071527)
- (en) Murai, Chatani et Kakiuchi, « Catalytic addition of C-H bonds to multiple bonds with the aid of ruthenium complexes », Catalysis Surveys from Asia, vol. 1, no 1, , p. 35–51 (ISSN 1384-6574, DOI 10.1023/A:1019064627386)
- (en) Yang, « Transition metal catalyzed meta-C–H functionalization of aromatic compounds », Org. Biomol. Chem., vol. 13, no 7, , p. 1930–1941 (ISSN 1477-0539, PMID 25522930, DOI 10.1039/c4ob02171a)
- Kakiuchi, Yamamoto, Chatani et Murai, « Catalytic Addition of Aromatic C–H Bonds to Acetylenes », Chemistry Letters, vol. 24, no 8, , p. 681–682 (ISSN 0366-7022, DOI 10.1246/cl.1995.681)
- (en) Rouquet et Chatani, « Ruthenium-catalyzed ortho-C–H bond alkylation of aromatic amides with α,β-unsaturated ketones via bidentate-chelation assistance », Chemical Science, vol. 4, no 5, , p. 2201 (ISSN 2041-6539, DOI 10.1039/c3sc50310k)
- (en) Sonoda, Kakiuchi, Chatani et Murai, « Ruthenium-Catalyzed Addition of Carbon-Hydrogen Bonds in Aromatic Ketones to Olefins. The Effect of Various Substituents at the Aromatic Ring », Bulletin of the Chemical Society of Japan, vol. 70, no 12, (ISSN 0009-2673, lire en ligne)
- Kakiuchi et Murai, « Catalytic C-h/olefin coupling », Accounts of Chemical Research, vol. 35, no 10, , p. 826–834 (ISSN 0001-4842, PMID 12379135, DOI 10.1021/ar960318p)
- Helmstedt et Clot, « Hydride ligands make the difference: density functional study of the mechanism of the Murai reaction catalyzed by [Ru(H)2(H2)2(PR3)2] (R=cyclohexyl) », Chemistry: A European Journal, vol. 18, no 36, , p. 11449–11458 (ISSN 1521-3765, PMID 22847874, DOI 10.1002/chem.201200757)
- Matsubara, Koga, Musaev et Morokuma, « Density Functional Study on Activation of ortho-CH Bond in Aromatic Ketone by Ru Complex. Role of Unusual Five-Coordinated d6 Metallacycle Intermediate with Agostic Interaction », Journal of the American Chemical Society, vol. 120, no 48, , p. 12692–12693 (ISSN 0002-7863, DOI 10.1021/ja9816943)
- Matsubara, Koga, Musaev et Morokuma, « Density Functional Study on Highly Ortho-Selective Addition of an Aromatic CH Bond to Olefins Catalyzed by a Ru(H)2(CO)(PR3)3 Complex », Organometallics, vol. 19, no 12, , p. 2318–2329 (ISSN 0276-7333, DOI 10.1021/om0001220)
- Guari, Sabo-Etienne et Chaudret, « Exchange Couplings between a Hydride and a Stretched Dihydrogen Ligand in Ruthenium Complexes », Journal of the American Chemical Society, vol. 120, no 17, , p. 4228–4229 (ISSN 0002-7863, DOI 10.1021/ja971603m)
- Buskens, Giunta et Leitner, « Activation and deactivation of a carbene containing non-classical ruthenium hydride complex in catalytic processes involving C–H bond cleavage », Inorganica Chimica Acta, vol. 357, no 6, , p. 1969–1974 (DOI 10.1016/j.ica.2004.01.018)
- Kakiuchi, Kochi, Mizushima et Murai, « Room-Temperature Regioselective C−H/Olefin Coupling of Aromatic Ketones Using an Activated Ruthenium Catalyst with a Carbonyl Ligand and Structural Elucidation of Key Intermediates », Journal of the American Chemical Society, vol. 132, no 50, , p. 17741–17750 (ISSN 0002-7863, PMID 21114294, DOI 10.1021/ja104918f)