Réaction de Barton-Kellogg
La réaction de Barton-Kellogg, oléfination de Barton-Kellogg[1], ou synthèse d'oléfine de Barton-Kellogg[2] est une réaction organique, plus précisément une réaction de couplage entre une thiocétone et un composé diazo formant un alcène via un intermédiaire 3,4-didéshydro-1,3,4-thiadiazolidine puis un épisulfure[3] - [4].
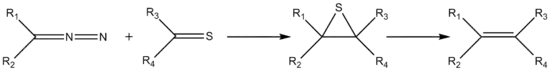
La publication de sa découverte a été faite simultanément et de façon indépendante en 1970 par le chimiste britannique Derek H. R. Barton[5] et par le chimiste néerlandais Richard M. Kellogg[6] - [7]. Toutefois, dès 1920, le chimiste allemand Hermann Staudinger avait décrit une réaction proche[8], ce qui fait qu'elle est parfois aussi appelée couplage diazo-thiocétone de Staudinger.
Mécanisme réactionnel
Dans cette réaction, le composé diazoïque (2), ici le 2-diazopropane, réagit comme un 1,3-dipôle dans une cycloaddition 1,3-dipolaire avec la thioacétone (1) pour donner une 3,4-didéshydro-1,3,4-thiadiazolidine. Cet intermédiaire est instable ; il expulse une molécule d'azote pour former un ylure de thiocarbonyle, qui se cyclise ensuite pour former un épisulfure (3) bien plus stable. La triphénylphosphine réagit ensuite comme un nucléophile, ouvrant le cycle à trois pour former un sulfaphosphatane. De manière similaire à la réaction de Wittig, cette structure expulse ensuite le sulfure de triphénylphosphine pour produire un alcène (4), ici le 2,3-diméthylbut-2-ène.

Mise en œuvre
Le composé diazo peut être obtenu à partir d'une cétone par réaction avec l'hydrazine, formant une hydrazone qui est ensuite oxydée. Il existe de nombreux réactifs pour cette conversion, par exemple l'oxyde d'argent(I) et le (bis(trifluoroacétoxy)iodo)benzène[9]. La thiocétone nécessaire à cette réaction peut être obtenue à partir de la cétone équivalente et de pentasulfure de phosphore. La désulfuration de l'épisulfure peut être réalisée par de nombreuses phosphines et également par de la poudre de cuivre.
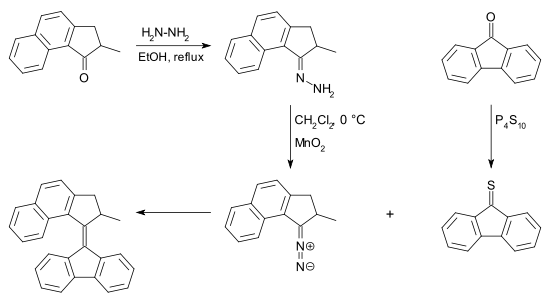
La réaction peut ainsi se résumer au couplage de deux cétones : l'une transformée avant réaction en diazo, l'autre en thiocétone. À cet égard, le principal avantage de cette réaction par rapport à la réaction de McMurry est le fait qu'elle puisse se faire entre deux cétones différentes, et permette ainsi de faire des réactions de couplage croisé au lieu de se limiter à des homocouplages.
Alternative
L'oléfinition de Barton-Kellogg peut également être réalisée à partir d'une cétone. La cétone est mise à réagir avec l'hydrazine et H2S pour former une 1,3,4-thiadiazolidine. Par oxydation avec l'acétate de plomb(IV), on obtient l'intermédiaire 3,4-didéhydro-1,3,4-thiadiazolidine, qui est converti thermiquement en alcène en présence de triphénylphosphane[3] - [4].
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Barton–Kellogg reaction » (voir la liste des auteurs) et en allemand « Barton-Kellogg-Olefinierung » (voir la liste des auteurs).
- Comprehensive Organic Name Reactions and Reagents, , 249–253 p. (ISBN 978-0-470-63885-9, DOI 10.1002/9780470638859.conrr056), « Barton-Kellogg olefination »
- Merck Index, 15e éd. (lire en ligne), « Barton olefin synthesis »
- (de) Wang, Zerong (Daniel Zerong), Comprehensive organic name reactions and reagents, Hoboken, N.J., John Wiley, , 3824 p. (ISBN 978-0-471-70450-8), p. 249-253
- (de) « Barton-Kellogg-Olefinierung », sur Römpp Online, Georg Thieme Verlag (consulté le )
- D. H. R. Barton et B. J. Willis, « Olefin synthesis by twofold extrusion processes », Journal of the Chemical Society D: Chemical Communications, no 19, , p. 1225 (DOI 10.1039/C29700001225)
- R. M. Kellogg et S. Wassenaar, « Thiocarbonyl ylides. An approach to "tetravalent sulfur" compounds », Tetrahedron Lett., vol. 11, no 23, , p. 1987 (DOI 10.1016/S0040-4039(01)98134-1)
- R. M. Kellogg, « The molecules R2CXCR2 including azomethine, carbonyl and thiocarbonyl ylides. Their syntheses, properties and reactions », Tetrahedron, vol. 32, no 18, , p. 2165–2184 (DOI 10.1016/0040-4020(76)85131-9)
- H. Staudinger et J. Siegwart, « Einwirkungen von aliphatischen Diazoverbindungen auf Thioketone », Helv. Chim. Acta, vol. 3, , p. 833–840 (DOI 10.1002/hlca.19200030178)
- Matthijs K. J. ter Wiel, Javier Vicario, Stephen G. Davey, Auke Meetsma et Ben L. Feringa, « New procedure for the preparation of highly sterically hindered alkenes using a hypervalent iodine reagent », Organic & Biomolecular Chemistry, vol. 3, , p. 28–30 (PMID 15602594, DOI 10.1039/b414959a, lire en ligne)