Réaction d'Ullmann
La réaction d'Ullmann ou couplage d'Ullmann[1] est une réaction de couplage entre deux halogénures d'aryle utilisant du cuivre. Cette réaction doit son nom à Fritz Ullmann[2].
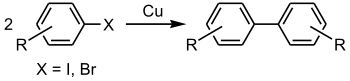
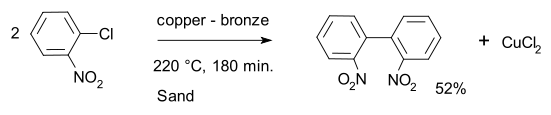
Un exemple classique de cette réaction est le couplage de deux ortho-chloronitrobenzène pour former le 2,2'-dinitrobiphényle à l'aide d'un alliage cuivre-bronze[3].
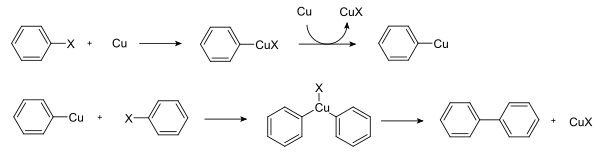
Mécanisme
Le mécanisme de la réaction d'Ullmann a été largement étudié. La résonance paramagnétique électronique exclut l'existence d'un intermédiaire radical. La séquence d'addition oxydante-élimination réductrice observée avec une catalyse au palladium est peu probable car le cuivreIII est rarement observé. Il semblerait que le système passe par la formation d'un organocuprate qui réagit avec un autre aryle pour réaliser une substitution nucléophile aromatique. Il existe des mécanismes alternatifs, comme une métathèse de liaison σ[4].
Améliorations de la réaction
La version classique de la réaction d'Ullmann utilise des conditions de réactions dures et est limitée aux halogénures d'aryles pauvres en électrons. La réaction est connue pour ses rendements irréguliers. Depuis sa découverte, de nombreuses améliorations et techniques alternatives ont été proposées[5].
Des variantes récentes de la réaction d'Ullmann utilisant le palladium et le nickel ont élargi la palette de substrats de la réaction et adouci les conditions réactionnelles. Cependant, les rendements sont généralement moyens[6]. En synthèse organique, cette réaction est souvent remplacée par des réactions de couplage au palladium comme la réaction de Heck, le couplage de Hiyama ou celui de Sonogashira.
En 2005, il a été montré qu'une réaction d'Ullmann catalysée par la (L)-proline pouvait avoir lieu en utilisant comme solvant un liquide ionique[7] - [8].
Réactions connexes
- Condensation d'Ullmann (synthèse d'éthers diaryliques par réaction d'halogénures d'aryle avec des phénols sous catalyse au cuivre)
- Synthèse de Jordan-Ullmann-Goldberg (synthèse de diarylamine à partir d'halogénures d'aryle avec des anilines sous catalyse au cuivre )
Références
- (en) P. E. Fanta, « The Ullmann Synthesis of Biaryls », Synthesis, no 1, , p. 9-21 (ISSN 0039-7881, DOI 10.1055/s-1974-23219).
- (de) F. Ullmann et J. Bielecki, « Ueber Synthesen in der Biphenylreihe », Ber. Dtsch. Chem. Ges., vol. 34, no 2, , p. 2174–2185 (ISSN 0365-9496, DOI 10.1002/cber.190103402141).
- (en) R. C. Fuson et E. A. Cleveland, « 2,2'-dinitrobiphenyl », Org. Synth., vol. 20, , p. 45 (ISSN 0078-6209, DOI 10.15227/orgsyn.020.0045).
- (en) Derek van Allen (dir. D. Venkataraman), Methodology and mechanism: reinvestigating the Ullmann reaction, University of Massachusetts Amherst (PhD Thesis), 2004, 127 p. [Electronic thesis].
- (en) J. Hassan, M. Sévignon et al., « Aryl−Aryl Bond Formation One Century after the Discovery of the Ullmann Reaction », Chem. Rev., vol. 102, no 5, , p. 1359–1470 (ISSN 0009-2665, DOI 10.1021/cr000664r).
- (en) T. D. Nelson et R. D. Crouch, Organic Reactions, vol. 63, New York, NY, John Wiley & Sons, , 555 p. (ISBN 978-0-471-44532-6, DOI 10.1002/0471264180.or063.03), chap. 3 (« Cu, Ni, and Pd Mediated Homocoupling Reactions in Biaryl Syntheses: The Ullmann Reaction »), p. 265-555.
- (en) Z. Wang, W. Bao et al., « L-Proline promoted Ullmann-type reaction of vinyl bromides with imidazoles in ionic liquids », Chem. Commun., no 22, , p. 2849-2851 (ISSN 1359-7345, DOI 10.1039/B501628B).
- Le liquide ionique utilisé est le BMIM-BF4 pour 1-Butyl-3-methylimidazolium tetrafluoroborate
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Ullmann reaction » (voir la liste des auteurs).