Pillararène
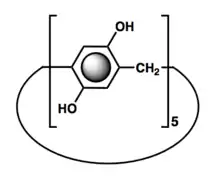
Les pillararènes sont des molécules macrocycliques composées d'unités hydroquinones (para-dihydroxybenzène) reliées en position para. Ils sont proches structurellement des cucurbituriles et des calixarènes, qui jouent un rôle important en chimie supramoléculaire. La première structure pillar[n]arène synthétisée fut celle comportant cinq unités.
Histoire
Le premier pillararène, le 1,4-diméthoxypillar[5]arène ou DMpillar[5]arène, a été décrit par Tomoki Ogoshi et al. en 2008 dans le Journal of the American Chemical Society. Ogoshi et al. ont catalysé la transformation du 1,4-diméthoxybenzène par un acide de Lewis avec du paraformaldéhyde pour obtenir ce composé. Les groupes méthoxy du DMpillar[5]arène sont déprotégés à l'aide du tribromure de bore pour donner le pillar[5]arène[1].
Structure
Les pillararènes sont constitués d'unités hydroquinones reliées en para par des ponts méthylène. Leur structure est symétrique, de forme cylindrique polyédrique avec une cavité à deux entrées de même dimension. Le pillar[5]arène possède la conformation la plus stable : ainsi, les autres pillararènes sont minoritaires lors de la cyclisation des monomères dérivés d'hydroquinone. D'autre part, des dérivés du pillar[5]arène peuvent être obtenus par fonctionnalisation des groupements hydroxyles[2].
Chiralité planaire
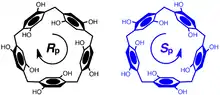
L'orientation des groupements hydroxyles ou étheroxydes de chaque côté des unités hydroquinones du pillararène donne une chiralité planaire au macrocycle. Quand les substituants sur les oxygènes des hydroquinones sont suffisamment petits ou qu'ils peuvent entrer dans la cavité du macrocycle, permettant d'éviter la rotation de la liaison O-H ou O-alkyl, la racémisation s'effectue spontanément. Si ces substituants sont suffisamment gros pour entraver la rotation, des macrocycles pillararènes optiquement purs peuvent être isolés[3] - [4].
Synthèse
Homopillararènes
Trois voies principales sont mises en œuvre pour synthétiser ces macrocycles(schéma 1)[5]. Toutes utilisent un acide (de Lewis ou de Brönsted) comme catalyseur.
- Condensation du 1,4-dialkoxybenzene avec du paraformaldéhyde catalysé par un acide de Lewis (comme le trifluorure de bore) ou de l'acide trifluorométhanesulfonique à température ambiante.
- Condensation du 1,4-dialkoxy-2,5bis(alkoxyméthyl)benzène catalysé par l'acide paratoluènesulfonique (APTS).
- Cyclooligomérisation d'alcools 2,5-dialkoxybenzyliques ou de composés 2,5-dialkoxybenzyl bromés avec un acide de Lewis approprié en tant que catalyseur.
Mécanisme
Les pillararènes sont formés habituellement par une cyclo-oligomérisation thermodynamiquement contrôlée de type réaction de Friedel-Crafts[6].
Copillararènes
En 2010, Zibin Zhang et al. ont ouvert de nouvelles voies de synthèse des copillararènes, qui sont des pillararènes constitués de n unités différentes qui possèdent d'intéressantes propriétés physiques, conformationnelles et d'associations hôte-invité. Deux voies sont suivies pour former ces macrocycles : fonctionnaliser sélectivement les homopillararènes ou co-oligomériser plusieurs monomères en présence d'un acide de Lewis catalyseur.
Champ d'application
Les pillararènes ont montré leurs applications potentielles pour la synthèse de nanoparticules, de canaux transmembranaires artificiels, de cristaux liquides[7], de vecteurs non viraux de l'ADN[8], et de liquides ioniques.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Pillararene » (voir la liste des auteurs).
- T. Ogoshi, S. Kanai, S. Fujinami, T.-a. Yamagishi, Y. Nakamoto, para-bridged symmetrical pillar[5]arenes: Their Lewis acid catalyzed synthesis and host-guest property, Journal of the American Chemical Society, 2008, vol. 130(15), pp. 5022–5023. DOI 10.1021/ja711260m.
- N. L. Strutt, R. S. Forgan, J. M. Spruell, Y. Y. Botros, J. F. Stoddart, Monofunctionalized Pillar[5]arene as a Host for Alkanediamines, J. Am. Chem. Soc., 2011, vol. 133, pp.5668-5671.
- T. Ogoshi, K. Masaki, R. Shiga, K. Kitajima, T.-a. Yamagishi, Org. Lett., 2011, vol. 13, pp. 1264-1266.
- N. L. Strutt, D. Fairen-Jimenez, J. Iehl, M. B. Lalonde, R. Q. Snurr, O. K. Farha, J. T. Hupp, J. F. Stoddart, J. Am. Chem. Soc., 2012, vol. 134, p. 17436.
- M. Xue,Y. Yang, X. Chi, Z. Zhang, F. Huang, Pillararenes, A New Class of Macrocycles for Supramolecular Chemistry, Accounts of Chemical Research, 2012, vol. 45(8), pp. 1294–1308.
- M. Holler, N. Allenbach, J. Sonet, J.-F. Nierengarten, The high yielding synthesis of pillar[5]arenes under Friedel-Crafts conditions explained by dynamic covalent chemistry, Chemical Communications, 2012, vol. 48, pp. 2576-2578
- I. Nierengarten, S. Guerra, M. Holler, J.-F. Nierengarten, R. Descheneaux, Building liquid crystals from the 5-fold symmetrical pillar[5]arene core, Chemical Communications, 2012, vol.48, pp. 8072-8074.
- I. Nierengarten, M. Nothisen, D. Sigwalt, T. Biellmann, M. Holler, J.-S. Remy, J.-F. Nierengarten, Polycationic pillar[5]arene derivatives: interaction with DNA and biological applications, Chemistry, a European Journal, 2013, vol. 19, pp. 17552-17558.