Oxalate d'ammonium
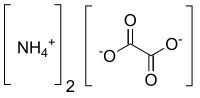
L'oxalate d'ammonium est un composé chimique aussi dénommé sel de diammonium de l'acide oxalique, de formule chimique (NH4)2C2O4 ou NH4OOCCOONH4 (formule brute C2H8N2O4).
| Oxalate d'ammonium | |
| |
| Identification | |
|---|---|
| No CAS | (monohydrate) |
| No ECHA | 100.012.912 |
| PubChem | 13531065 |
| SMILES | |
| InChI | |
| Apparence | cristal blanc inodore[1] |
| Propriétés chimiques | |
| Formule | C2H8N2O4 [Isomères] |
| Masse molaire[2] | 124,095 9 ± 0,003 8 g/mol C 19,36 %, H 6,5 %, N 22,57 %, O 51,57 %, |
| Propriétés physiques | |
| T° fusion | 70 °C (décomposition)[1] |
| Solubilité | 45 g·l-1 (eau, 20 °C)[1] |
| Masse volumique | 1,48 g·cm-3 (20 °C)[1] |
| Précautions | |
| SGH[1] | |
| H302 et H312 |
|
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Ce produit chimique a l'aspect d'une poudre cristalline incolore et inodore. En solution, il se dissout pour former des ions ammonium NH4+ et des ions oxalate C2O42−.
Sa masse molaire est de 124,1 grammes par mole.
Fabrication
L'oxalate d'ammonium peut être obtenu par neutralisation chimique d'acide oxalique avec de l'ammoniac.
Utilisation
En laboratoire de chimie, on peut utiliser une solution d'oxalate d'ammonium comme test de reconnaissance pour identifier des ions calcium, Ca2+
- L'ion Ca2+ réagit avec l'ion C2O42− pour former un précipité d'oxalate de calcium CaC2O4(s). Ce précipité obtenu est un précipité blanc.
- L'équation de la réaction est : Ca2+ + C2O42− → CaC2O4.
L'oxalate d'ammonium est aussi utilisé pour éviter la coagulation du sang (anticoagulant).
Notes et références
- Entrée « Ammonium oxalate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 15 novembre 2012 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.

