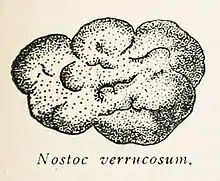
Nostoc verrucosum
Nostoc verrucosum est une espèce rhéophile de cyanobactéries (groupe de bactéries dotées de capacités de photosynthèse).
| Règne | Bacteria |
|---|---|
| Division | Cyanobacteria |
| Classe | Cyanophyceae |
| Ordre | Nostocales |
| Famille | Nostocaceae |
| Genre | Nostoc |
| Sous-règne | Eubacteria |
|---|---|
| Clade | Glycobacteria |
| Clade | Cyanobacteria |
| Clade | Phycobacteria |
| Classe | Hormogoneae |
| Ordre | Nostocales |
Cette espèce forme habituellement des colonies et arrangements « globulaires » gélatineux (dits « ashitsuki » au Japon[1]). Ces colonies, qui se rencontrent dans certaines eaux claires et froides (13 à 14 °C au Japon), peuvent mesurer de quelques centimètres à quelques dizaines de centimètres de circonférence ou de longueur. En raison de sa ressemblance avec certaines algues marines, on a autrefois cru qu'il s'agissait d'une algue d'eau douce[2].
Elle est considérée comme toxique en Amérique du Nord, mais semble pourtant avoir été traditionnellement consommée en Asie dans certaines régions et pays (Japon et Thaïlande) ; elle s’est raréfiée à la suite de la dégradation ou disparition de ses habitats naturels[3] y compris en Europe, au point qu'en 1999 Mollenhauer et ses collègues alertent sur le fait que les formes de colonies macroscopiques de nostocs aquatiques sont négligées par les inventaires naturalistes et en danger dans la biodiversité subaquatique européenne[4].
Selon Naoya Oku[5] cette espèce était autrefois beaucoup plus commune au Japon où elle était couramment consommée, et il lui reste de ces époques de nombreux noms vernaculaires japonais comme ashi-tsuki[1] ; kotobuki-nori ; kotobuki–dake à Okayama[6] ; mitoku-nori » à Tottori[7] ; shiga-nori » à Shiga [8].
Description
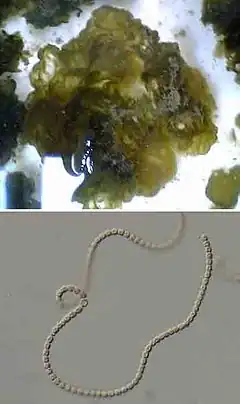
Ces colonies macroscopiques forment à la fois des filaments cellulaires[9], qui montrent à moyen grossissement au microscope un aspect de plat de spaghettis, chaque spaghetti apparaissant à plus fort grossissement comme un « collier de perles » comme le montre l’illustration ci-contre) et des matériaux de matrice extracellulaire massive[9].
Les colonies sont de couleur brunâtre, vert-olive[10], verdâtre à noirâtre, relativement translucide à la lumière.
Leur apparence est souvent proche de celle des colonies du nostoc commun (confusion possible), mais elles croissent sous l’eau de manière fixée (périphyton) ou sur des supports perpétuellement éclaboussés[9] et non sur des substrats secs périodiquement exposés à la pluie ou à de fortes rosées comme le fait le nostoc commun.
Les colonies présentent une consistance molle, gélatineuse, glissante et veloutée au touché.
Certains auteurs ont observé (en Inde, au Cachemire et au Ladakh) des formes en « grosses boules vertes »[11].
Habitat
Cette espèce est aquatique et uniquement présente en eau douce, à la différence de la plupart des autres nostocs qui sont « terrestres ». Elle est rhéophile, typique des eaux claires et fraîches des ruisseaux et cours d’eau rapides voire torrentueux et se retrouve même parfois sous les cascades.
En termes d’occupation longitudinale de la rivière, selon Dell’Uomo, A., & Torrisi, M. (2009), elle est typique des sections de métarhithron et de l’hyporhithron[12].
Elle a été signalée en Espagne dans des zones temporairement immergées, au sein d’encroûtements formés en bordure de bassins artificiels utilisés saisonnièrement pour l’irrigation dans une région semi-aride[13].
Il a été montré à cette occasion que les réservoirs d’eau construits en polyéthylène basse densité (LDP) (même recouvert de pierres et de sable) sont moins riches en biodiversité que ceux construits en polyéthylène haute densité (HDP) tant pour les microphytes que pour les macrophytes, et en été comme en hiver.
Similarités et différences avec le Nostoc commun
Une analyse génétique de la séquence d'ADNr 16S de la souche (japonaise) KU005 de N. verrucosum a montré une identité de 95 % par rapport à la souche KU002 du Nostoc commun. Ceci laisse penser que, quoique génétiquement proches, ces cyanobactéries sont des espèces bien différenciées[9].
Les colonies de Nostoc commun longtemps ennoyées se délitent dans l’eau alors que les colonies de Nostoc verruqueux y sont parfaitement adaptées, tant que la qualité de l'eau leur convient. Elles peuvent se fixer solidement au substrat, ce qui n'est pas le cas des colonies de nostoc commun, et résister, dans une certaine mesure, au courant ou à des chutes d’eau.
Cette espèce prospère localement dans certains habitats aquatiques tels que le lit des ruisseaux peu profonds, dans les zones de chutes d'eau et le sous-bois humide et alcalins de forêts tropicales.
Comme d'autres espèces Nostoc, cet organisme fixe l'azote et fournit des nutriments importants à certaines plantes, en entrant en symbiose avec elles. Il peut être symbiote d'un champignon et former certains lichens.
Comme tous les autres organismes procaryotes, la cellule est dépourvue de noyau et 70 % à 85 % de son cytoplasme est constitué d'eau.
Les nostocs soumis à l’exondation, et sous forme desséchée (forme de vie dite anhydrobiotique[14]) et — dans une certaine mesure — soumis aux UV solaires sont généralement considérés comme pouvant rester « dormants » durant de longues périodes de temps et périodiquement et rapidement retrouver une activité métabolique quand ils sont réhydratés y compris pour l'espèce commune Nostoc commune dans le cas de spécimens conservés desséchés durant 80 ans en herbier[15].
Selon Shin (1977), Nostoc verrucosum est néanmoins bien plus sensible à la déshydratation que le Nostoc commun[9], mais par contre il semble mieux adapté aux environnements froids. La plupart des cellules d’une colonie résistent facilement à des cycles de congélation/décongélation, ce qui permet à cette espèce de survivre à des conditions extrêmes de froid (on en trouve ainsi en Arctique et Antarctique[16]).
Les colonies naturelles de la cyanobactérie Nostoc verrucosum étudiées par Shin dans les années 1970 présentaient des taux de chlorophylle a, de caroténoïdes, de pigments scytonémine (absorbant les rayons UV solaires), d’acides aminés, de mycosporine et d'acide uronique [un composant des polysaccharides extracellulaires (PES)] comparables à ceux du Nostoc commun[9]. Leurs compositions en sucre diffèrent mais les PES de cette espèce et ceux du Nostoc commun présentent tous deux une faible acidité et une affinité élevée pour les cations divalents.
La « protéine WspA », reconnue comme étant une composante majeure de la matrice extracellulaire formant les colonies de nostoc commun et considérée comme une protéine permettant la résistance au stress hydrique[17] - [18] - [19], a aussi été détectée chez N. verrucosum.
Chez ces deux espèces le processus de dessiccation provoque des niveaux élevés d'accumulation de tréhalose. Les études antérieures considéraient que cette tréhalose permettait l’anhydrobiose chez les nostocs, mais les données de provenant de l’étude du Nostoc verrucosum laissent penser que ni la production d’une matrice extracellulaire ni l'accumulation de tréhalose suffisent à permettre la déshydratation extrême chez N. verrucosum.
Biochimie
Ferrédoxines
Deux ferrédoxines végétales (Protéines fer-soufre) baptisées « ferrédoxine I (Fd I) » et « ferrédoxine II (Fd II) » ; de poids moléculaire identique (18000), et chacune dotée de deux atomes de fer non-hème et deux de atomes de soufre labile) ont été identifiées à partir d’échantillons de ce nostoc. Ces ferrédoxines ont une activité photoréductrice -NADP et enzymatique (NADP-cytochrome c reductase)[20] - [21]
Accumulation de phosphore environnemental par le Nostoc verruqueux
À la fin des années 1960, il a été montré que les colonies denses de Nostoc verrucosum (mais pas les formes plus tendres de Nostoc commun) peuvent accumuler du phosphate à partir de leur environnement, apparemment par des moyens « passifs ». Cette accumulation de phosphate peut être réduite en prétraitant les colonies avec un agent chélatant, alors qu’inversement la présence de CaCl2 (agent très hygroscopique, notamment utilisé pour le salage des routes en zone froide, additif du ciments, qui a un effet désherbant) augmente cette captation[22].
Association mutuelle avec un insecte
En 2000, Sergi Sabater et Isabel Muñoz de l’Université de Barcelone rapportent la colonisation de colonies globulaires (globules de forme légèrement comprimée, disposée parallèlement ou légèrement oblique par rapport au flux du courant de 1,4 mm d'épaisseur, 3,1 mm de long et 2,4 mm de largeur) de cette espèce par une larve de chironome (Cricotopus sp.) dans un torrent de montagne espagnol (Riera Major dans le nord-est du pays, à 90 km au nord de Barcelone)[23]. La découverte date d’. Dans cet environnement la larve n’a été trouvée qu’à l’intérieur de globules de nostoc et jamais sur le substrat[23].
Une association entre un nostoc (N. parmelioides) et ce genre de Chironomidés avait déjà été décrite en Amérique du Nord en zone tempérée et en zone boréale par S.V Gregory en 1983[24] et W.K Dodds & al. en 1995[25]. Les colonies de N. verrucosum présentaient une forme plus globulaires que ceux de Nostoc parmelioides également colonisés par des chironomes (Cricotopus ; Nostococladius), lesquels présentaient un aspect plus « chiffoné » (semblables à des oreilles)[23]. La colonisation ne semble pas présenter de bénéfice particulier pour le nostoc concernant ses préférences en termes de courant/écoulement et d'exposition à la lumière dans l'habitat (ruisseau) où il se développe.
Utilisations
Alimentation
Les colonies gélatineuses de cette espèce ont autrefois été récoltées et mangées au Japon ; au moins jusqu’au XVIIIe siècle[26] de même semble-t-il qu’en Thaïlande[26].
Usage médical
En laboratoire, un extrait éthanolique de colonies inhibe la croissance de bactéries Gram-positives[3] et a pu inhiber la croissance de Staphylococcus aureus à la dose de 64 μg/mL[3].
Bioindication
Les cyanobactéries, notamment parce que beaucoup présentent une certaine toxicité ont souvent été proposées comme indicateurs biologiques de pressions anthropiques sur l’environnement, mais ces espèces sont souvent difficiles à déterminer pour les non-spécialistes, et ce qu’elles indiquent doit encore être mieux précisé.
Quelques études ont inclus des cyanobactéries aquatiques d’eau douce. Ces cyanobactéries semblent pour certaines pouvoir être utile pour indiquer ou tracer (en cours d’eau rapide[27]) certains phénomènes d’eutrophisation, testé en Europe du Nord[28] ou dans les Pyrénées en France[29]
- des taux trop élevés d’orthophosphates (indicateur d’eaux usées urbaines mal épurées ou de rejets en rivière). Nostoc verrucum s’est révélé être un bon candidat pour ce facteur de pression environnementale (de même que Phormidium autumnale, Plectonema tomasinianum, Rivularia haematites, Tolypothrix distorta selon Laura Monteagudo & Jose Luis Moreno en 2016[30]). Dans ce même contexte, toutes les espèces étaient plus fréquentes à faible concentration de phosphate dans l’eau et Phormidium favosum semble y être l'espèce la plus tolérante[30].
- des « anomalies » du taux de nitrates (trop peu ou trop) ; ainsi en Espagne dans la zone étudiée par … seul N. verrucosum et Phormidium favosum semblent pouvoir croître dans une eau à plus de 12 mg de NO3-N l-1. P (taux devenus courant dans les contextes d’agriculture intensive), alors que Phormidium fonticola était associé aux valeurs de nitrate les plus faibles et étant le moins tolérant à ce nutriment[30]. Dans la zone étudiée les formes coloniales avaient disparu des paysages composés à plus de 20 % de sols cultivé avec des variations d’espèces selon que l’agriculture était irriguée ou non.
- les phénomènes d’acidification des eaux douces (AIP ou « acidification index periphyton », utile pour détecter les premiers signes d'une tendance à l'acidification ou les dernières étapes d'un processus de récupération, dans une gamme de pH annuels moyens compris entre 5,5 et 7,0, et dans les habitats typique des nostocs aquatiques).
Au Japon, des espèces de Cyanophycées (dont cette espèce) sont utilisées (ou l’ont été) comme médicaments et engrais azotés[31].
Notes et références
- Koidzumi G. Shokubutsugaku Zasshi. 1919;33:263–264. Japanese.
- William Shurtleff & Akiko Aoyagi (2014), « History of Soybeans and Soyfoods in Japan, and in Japanese Cookbooks and Restaurants outside Japan » (701 CE to 2014) ; Soyinfo Center, 19 février 2014- ; voir p 1666/3377
- Oku, N., Yonejima, K., Sugawa, T., & Igarashi Y (2014). Identification of the n-1 fatty acid as an antibacterial constituent from the edible freshwater cyanobacterium Nostoc verrucosum | Bioscience, biotechnology, and biochemistry, 78(7), 1147-1150
- Mollenhauer, D., Bengtsson, R., & Lindstrøm, E. A. (1999), Macroscopic cyanobacteria of the genus Nostoc: a neglected and endangered constituent of European inland aquatic biodiversity. European Journal of Phycology, 34(4), 349-360 DOI:10.1080/09670269910001736412
- Universitaire japonais spécialisé en bioscience, biotechnologies et biochimie, au centre de recherche en biotechnologies de l’Université de Toyama.
- Harada N. Bull Niimi Coll. 2007;28:202–215
- Hirose H, Hirano M, Hirose H, Yamagishi T, editors. Illustration of the Japanese fresh-water algae. Tokyo: Uchida Rokakuho; 1977. p. 31–99
- Komatsuzaki M. In: Shigaken hoshokai, Shigaken hoshokai, editors. Shigaken tennenkinenbutsu chohsahohkoku (en Japonais). Vol. 1. Shiga; 1924. p. 31.
- Shin, M., Sukenobu, M., Oshino, R., & Kitazume, Y. (1977). Two plant-type ferredoxins from a blue-green alga, Nostoc verrucosum. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 460(1), 85-93 (résumé)
- Richardson, J. W., & Gaufin, A. R. (1971). Food habits of some western stonefly nymphs. Transactions of the American Entomological Society (1890-), 97(1), 91-121 (résumé).
- Compère, P. (1983). Some algae from Kashmir and Ladakh, W. Himalayas. Bulletin de la Société Royale de Botanique de Belgique/Bulletin van de Koninklijke Belgische Botanische Vereniging, 141-160
- Dell’Uomo, A., & Torrisi, M. (2009). Freshwater algae and their use for safeguarding the Mediterranean basin. Bocconea, 23, 93-105
- Asencio, A. D. (2014). Diversity and distribution of microphytes and macrophytes in artificial irrigation ponds in a semi-arid mediterranean region (SE Spain. International Journal of Environmental Research, 8(3), 531-542
- Crowe JH, Carpenter JF & Crowe LM (1998) The role of vitrification in anhydrobiosis. Annu Rev Physiol 60: 73–103
- Lipman CB (1941) The successful revival of Nostoc commune from a herbarium specimen eighty-seven years old. B Torrey Bot Club 68: 664–666.
- Singh, S. M., Singh, P., & Thajuddin, N. (2008). Biodiversity and distribution of cyanobacteria at Dronning Maud Land, East Antartica
- Hershkovitz N, Oren A & Cohen Y (1991) Accumulation of trehalose and sucrose in cyanobacteria exposed to matric water stress. Appl Environ Microb 57: 645–648
- Potts M (1994) Desiccation tolerance of prokaryotes. Microbiol Rev 58: 755–805.
- Toshio Sakamoto, Takayuki Yoshida, Hiromi Arima, Yuji Hatanaka, Yayoi Takani, Yoshiyuki Tamaru (2009) “Accumulation of trehalose in response to desiccation and salt stress in the terrestrial cyanobacterium Nostoc commune” 12 février 2009 ; Phycological Research ; DOI: 10.1111/j.1440-1835.2008.00522.x
- Shin, M., Sukenobu, M., Oshino, R., & Kitazume, Y. (1977). Two plant-type ferredoxins from a blue-green alga, Nostoc verrucosum. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 460(1), 85-93 (résumé)
- Sakamoto, T., Kumihashi, K., Kunita, S., Masaura, T., Inoue-Sakamoto, K., & Yamaguchi, M. (2011). The extracellular-matrix-retaining cyanobacterium Nostoc verrucosum accumulates trehalose, but is sensitive to desiccation. FEMS microbiology ecology, 77(2), 385-394 (résumé)
- Whitton B.A (1967). Phosphate accumulation by colonies of Nostoc. Plant and Cell Physiology, 8(2), 293-296 (résumé)
- Sabater, S., & Muñoz, I. (2000). Nostoc verrucosum (cyanobacteria) colonized by a chironomid larva in a Mediterranean stream (Note). Journal of Phycology, 36(1), 59-61
- Gregory, S. V. (1983). Plant–herbivore interactions in stream systems In Barnes, J. R. & Minshall, G. W. [Eds.] Stream Ecology. Plenum Press, New York, pp. 157–89
- Dodds, W. K., Gudder, D. A. & Mollenhauer, D. 1995. The ecology of Nostoc. J. Phycol. 31:2–18
- Johnson HE, King SR, Banack SA, Webster C, Callanaupa WJ. J (2008). Ethnopharmacol.;118:159–165.10.1016/j.jep.2008.04.008
- Douterelo, I., Perona, E., & Mateo, P. (2004). Use of cyanobacteria to assess water quality in running waters. Environmental pollution, 127(3), 377-384 (résumé).
- Schneider S.C & Lindstrøm E A (2011). The periphyton index of trophic status PIT: a new eutrophication metric based on non-diatomaceous benthic algae in Nordic rivers. Hydrobiologia, 665(1), 143-155 (résumé).
- Mateo P, Berrendero E, Perona E, Loza, V., & Whitton, B. A. (2010). Phosphatase activities of cyanobacteria as indicators of nutrient status in a Pyrenees river. Hydrobiologia, 652(1), 255-268.
- Monteagudo L & Moreno J.L (2016), Benthic freshwater cyanobacteria as indicators of anthropogenic pressures ; Ecological Indicators ; août 2016; DOI: 10.1016/j.ecolind.2016.03.035
- Watanabe A (1970). Studies on the Application of Cyanophyta in Japan. Aquatic Sciences-Research Across Boundaries, 32(2), 566-569 (résumé)
Voir aussi
Articles connexes
Bibliographie
- Dodds, Walter K. (1995). L'écologie de Nostoc. Journal of Phycology vol 33 (1) février . 2-18.
- Ehling-Schultz, Monika et al. (1997) Synthèse induite par UV-B de pigments photoprotecteurs et de polysaccharides extracellulaires dans la commune de cyanobactéries terrestres Nostoc . Journal of Bacteriology vol 179 (6) . 1940-1945.
- Hutson, K. G., Rogers, L. J., Haslett, B. G., Boulter, D., & Cammack, R. (1978). Comparative studies on two ferredoxins from the cyanobacterium Nostoc strain MAC. Biochemical Journal, 172(3), 465-477.
- Oku, N., Yonejima, K., Sugawa, T., & Igarashi, Y. (2014). Identification of the n-1 fatty acid as an antibacterial constituent from the edible freshwater cyanobacterium Nostoc verrucosum. Bioscience, biotechnology, and biochemistry, 78(7), 1147-1150.
- Richardson J.W & Gaufin A.R (1971). Food habits of some western stonefly nymphs. Transactions of the American Entomological Society (1890-), 97(1), 91-121 (résumé).
- Scherer, S. et al. (1988), Un nouveau pigment protecteur UV-A / B dans la commune de cyanobactéries terrestres Nostoc . Plant Physiology vol 88 . 1055-1057.
- Shin, M., Sukenobu, M., Oshino, R., & Kitazume, Y. (1977). Two plant-type ferredoxins from a blue-green alga, Nostoc verrucosum. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 460(1), 85-93 (résumé).
- Watanabe A (1970). Studies on the Application of Cyanophyta in Japan. Aquatic Sciences-Research Across Boundaries, 32(2), 566-569 (résumé).
- Webb, David T. Cycad Root Nodules. Département de Botanique, Université de Hawai'i à Manoa.