Néohexène
Le néohexène, ou 3,3-diméthylbutène, est un hydrocarbure aliphatique insaturé de formule chimique (CH3)3CCH=CH2. Il s'agit d'un liquide inodore et incolore pratiquement insoluble dans l'eau[3].
| Néohexène | |
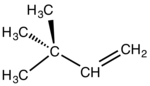
| |
| Structure du néohexène | |
| Identification | |
|---|---|
| Nom UICPA | 3,3-Diméthylbut-1-ène |
| Nom systématique | 3,3-Diméthyl-1-butène, 3,3-diméthylbutène |
| No CAS | |
| No ECHA | 100.008.361 |
| No CE | 209-195-9 |
| PubChem | 11210 |
| SMILES | |
| InChI | |
| Apparence | liquide inodore incolore à jaunâtre[1] |
| Propriétés chimiques | |
| Formule | C6H12 [Isomères] |
| Masse molaire[2] | 84,159 5 ± 0,005 6 g/mol C 85,63 %, H 14,37 %, |
| Propriétés physiques | |
| T° fusion | −115 °C[1] |
| T° ébullition | 41 °C[1] |
| Masse volumique | 0,65 g/cm3[1] à 20 °C |
| Point d’éclair | −28 °C[1] |
| Limites d’explosivité dans l’air | à partir de 1,2 % en volume[1] |
| Pression de vapeur saturante | 479,9 hPa[1] à 20 °C |
| Précautions | |
| SGH[1] | |
  Danger |
|
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Le néohexène peut être obtenu par métathèse des alcènes à partir de diisobutylène (CH3)3CCH=C(CH3)2 avec l'éthylène CH2=CH2 en donnant également de l'isobutylène CH2=C(CH3)2[4] :
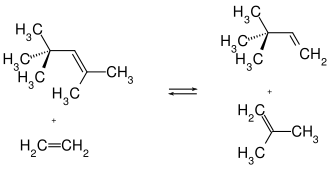
Métathèse entre le diisobutylène et l'éthylène pour produire le néohexène et l'isobutylène.
Il est utilisé dans la fabrication de parfums[4] — senteur de musc[5] - [6], par réaction avec le p-cymène. Il est également utilisé dans la production de terbinafine[7] ainsi que comme accepteur d'hydrogène dans l'étude de l'activation de liaison C-H[8].
Notes et références
- Entrée « 3,3-Dimethylbutene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 1 novembre 2022 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics. A Ready-reference Book of Chemical and Physical Data, CRC Press, 1995, p. 214. (ISBN 978-0-8493-0595-5)
- (de) Christoph Janiak, Hans-Jürgen Meyer, Dietrich Gudat et Ralf Alsfasser, Riedel Moderne Anorganische Chemie, 4e éd., Walter de Gruyter., Berlin/Boston, p. 822. (ISBN 978-3-11-024900-2)
- (en) Ezat Khosravi et T. Szymanska-Buzar, Ring Opening Metathesis Polymerisation and Related Chemistry State of the Art and Visions for the New Century, Springer Science & Business Media, 2012, p. 250. (ISBN 978-94-010-0373-5)
- (en) D. H. Pybus et C. S. Sell, The Chemistry of Fragrances, Royal Society of Chemistry, 1999, p. 96. (ISBN 978-0-85404-528-0)
- (en) Lionel Delaude et Alfred F. Noels, « Metathesis », Kirk-Othmer Encyclopedia of Chemical Technology, (DOI 10.1002/0471238961.metanoel.a01, lire en ligne).
- (en) Fuchen Liu, Esther B. Pak, Bharat Singh, Craig M. Jensen et Alan S. Goldman, « Dehydrogenation of n-Alkanes Catalyzed by Iridium “Pincer” Complexes: Regioselective Formation of α-Olefins », Journal of the American Chemical Society, vol. 121, no 16, , p. 4086-4087 (DOI 10.1021/ja983460p, lire en ligne).
Cet article est issu de wikipedia. Text licence: CC BY-SA 4.0, Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.
