Magallana gigas
Magallana gigas, aussi appelée huître creuse du Pacifique (précédemment Crassostrea gigas), est une huître creuse du genre Magallana originaire du nord-ouest de l'océan Pacifique. Elle est aussi souvent dénommée « huître japonaise », mais cette dénomination ambigüe se rapporte plutôt à la Magallana nippona.

- Crassostrea gigas (Thunberg, 1793)
- Ostrea gigas Thunberg, 1793
Introduite dans 48 pays depuis le début du XXe siècle (1966 en France) à des fins économiques, pour remplacer les stocks d'huîtres indigènes épuisés par la surexploitation ou les maladies, elle est devenue l'huître la plus élevée au monde[1]. Sa production globale était en 2003 de 4,38 millions de tonnes (dont 84 % en Chine), dépassant ainsi toutes les autres espèces marines relevant de l'aquaculture[2]. Elle représente 99 % de la production française au début du XXIe siècle[3]. 100 000 tonnes d'huîtres creuses sont produites annuellement en France alors que les huîtres sauvages, qui colonisent préférentiellement tous les substrats rocheux mais également les structures ostréicoles laissées à l'abandon ou les infrastructures marines humaines (cale, jetée), constituent un stock de 200 000 tonnes, avec des biomasses pouvant atteindre plus de 50 kg/m2[4].
Espèce colonisatrice, elle est devenue invasive dans plusieurs régions, en raison de différents facteurs (réchauffement climatique, pollution par les nitrates, développement des populations sauvages issues des installations ostréicoles), ce qui pose de multiples problèmes écologiques et économiques (banalisation de la faune littorale, valorisation peu rentable du fait de la contamination éventuelle[5] ou des coûts élevés de ramassage et de transport)[6] - [7].
Description
Cette huître a une coquille inéquivalve (deux valves différentes inéquilatérales), extrêmement rugueuse, très cannelée, et laminée. De forme variable, elle a tendance à être oblongue avec un bord crênelé. Sa valve (inférieure) gauche est profondément creuse et sculptée de grossières arêtes concentriques crénelées et coupantes (arêtes correspondant à des stries de croissance étudiées par la sclérochronologie, et délimitant des lames concentriques écailleuses). Même déformée, cet aspect la rend très caractéristique. Fréquemment, 6 ou 7 côtes épaisses (plis calcaires ondulés) forment une profonde marque sur la marge de la coquille. Sa valve (supérieure) droite plate ou légèrement convexe se repose à l'intérieur de la gauche et a des sculptures similaires. Le crochet et l’umbo qui se forment sur la charnière de la coquille sont souvent envahis par ces plis calcaires. La couleur est souvent grisâtre à verdâtre, avec plusieurs raies et taches pourpres rayonnant loin de l'umbo. L'intérieur de la coquille est blanc, avec un muscle adducteur qui est parfois sombre, mais jamais pourpre ou noir[8].
 Coquille.
Coquille.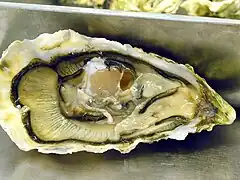 Corps.
Corps. En cuisine.
En cuisine.
Biologie
Reproduction
La sexualité de l'huître creuse a très tôt été décrite comme reposant sur un hermaphrodisme successif. La détermination du sexe est un phénomène complexe qui est régulé par de nombreux facteurs environnementaux (température, nourriture…) et internes, si bien qu'on peut parler aussi d'un mode de reproduction qui relève du gonochorisme (présence d'un seul sexe au plus, mâle ou femelle, chez un individu)[9].
La maturation sexuelle et la gamétogenèse commencent à la fin de l’hiver et se poursuivent jusque vers le mois de juillet, période de la fécondation externe[10]. Cette fécondation a lieu préférentiellement durant le flot de la marée. La ponte peut se produire plusieurs fois durant l’été, lorsque la température de l’eau est supérieure à un seuil (18 à 20 °C), et sa durée aller de quelques minutes à plus d’une heure. Chez la femelle, elle se traduit par de violents mouvements valvaires, ce qui rend la ponte détectable au moyen d’un enregistrement de l’activité valvaire. Chez le mâle, c’est une importante action des cils qui propulse les spermatozoïdes à l’extérieur[11].
La stratégie reproductive de type r est liée à la forte mortalité de la phase planctonique de l'huître. La fécondité est très élevée : une femelle libère entre 20 et 100 millions d’œufs non fécondés par ponte, contre un million pour l'huître plate[12] - [13].
Cycle de vie

Cette huître est une espèce ovipare hermaphrodite protandre successive[14].
La gamétogénèse est active au printemps et se traduit par le développement de la gonade autour de la glande digestive (en maturant, cet organe reproducteur devient blanchâtre : l'huître est dite « laiteuse »). La fécondation externe a lieu après l'émission de spermatozoïdes et d'ovocytes une ou plusieurs fois par été lorsque la température de l'eau est supérieure à un seuil d'environ 18 – 20 °C[15]. L'œuf fécondé donne une larve planctonique qui dérive avec la masse d’eau pendant environ 20 jours[16]. Cette phase larvaire passe par différents stades : la larve trochophore devient, au bout de 24 heures environ, une larve D puis une larve véligère qui mesure 60 µm. Vivant de ses réserves énergétiques, elle devient strictement planctotrophe au bout de 5 jours environ[17].
La larve véligère dispose d’un velum, une sorte de voile cilié, qui lui sert à se déplacer et à capturer ses proies. Elle se recouvre rapidement d'une coquille larvaire, la prodissoconque (en) (larve umbonée). À la fin du stade larvaire (en moyenne deux à trois semaines), elle atteint 300 µm, se munit d’un pied (larve dite pédivéligère) qui lui permet de ramper pour choisir le substrat sur lequel elle va se fixer et lui sécrète le ciment pour la fixation. Une fois fixée, la larve devenue naissain commence sa métamorphose et le développement des organes de l’adulte[18].
Une phylogénie controversée
Originellement placée dans le genre-type des huîtres Ostrea, cette espèce a été connue pendant tout le XXe siècle sous le nom de « Crassostrea gigas », mais une étude génétique de 2017 l'a redéplacée dans le genre Magallana, ainsi que plusieurs autres espèces du même genre[19].
Cependant, cette classification phylogénétique est controversée car elle repose sur un critère qui, selon un consortium international de chercheurs reconnus[20], est trop partiel pour être validé. En effet, l'utilisation d'un seul critère moléculaire chez une des rares espèces de mollusques marins d'intérêt commercial dont le génome entier est disponible depuis plusieurs années [21] ne fait pas consensus sur sa pertinence. En conséquence, cette proposition de changement taxonomique,pour l'espèce Crassostrea gigas, qui n'est supportée à ce jour que par deux articles émanant des mêmes auteurs n'est pas adoptée par la communauté scientifique spécialisée. Ceci est illustré par la persistance de la dénomination Crassostrea gigas dans une large majorité d'articles de la littérature scientifique spécialisée depuis la parution en 2017 de la proposition de changement taxonomique par Salvi et collègues. Toutefois, l'organisme officiel de nomenclature biologique, le World Register of Marine Species, nomme désormais cette espèce Magallana gigas[22] .
Selon des critères similaires, plusieurs analyses phylogéniques font apparaître l'« huître portugaise » (Magallana angulata) comme un morphotype local de l'huître creuse japonaise[23] - [24].
Voir aussi
Références taxonomiques
- (en) Référence World Register of Marine Species : espèce Crassostrea gigas (Thunberg, 1793)
- (fr+en) Référence ITIS : Crassostrea gigas (Thunberg, 1793)
- (fr) Référence Catalogue of Life : Crassostrea gigas (Thunberg, 1793)
- (en) Référence Animal Diversity Web : Crassostrea gigas
- (en) Référence NCBI : Crassostrea gigas (taxons inclus)
Bibliographie
- Salvi D. et Mariottini P., « Molecular taxonomy in 2D: a novel ITS2 rRNA sequence-structure approach guides the description of the oysters' subfamily Saccostreinae and the genus Magallana (Bivalvia: Ostreidae) », Zoological Journal of the Linnean Society, vol. 179, no 2, , p. 263-276 (DOI 10.1111/zoj.12455, lire en ligne).
Liens externes
- (en) Référence GISD : espèce Crassostrea gigas
- (en) CIESM Atlas of Exotic Molluscs in the Mediterranean
- Jean Etienne, « L’huître japonaise envahit les côtes européennes », Futura-Sciences
- Leslie Coïc, « Étude dynamique de l'ostréiculture dans le bassin de Marenne-Oléron depuis l'introduction de l'huître japonaise Crassostrea gigas : de la production à la prolifération »,
- Page sur l'huître creuse du Pacifique sur le site de Pêches et Océans Canada.
Notes et références
- (en) Ruesink, J.L., HS. Lenihan, A.C. Trimble, K.W. Heiman, F. Micheli, J.E. Byers, & M.C. Kay, « Introduction of non-native oysters: Ecosystem effects and restoration implications », Annual Review of Ecology Evolution and Systematics, vol. 36, , p. 643–689 (DOI 10.1146/annurev.ecolsys.36.102003.152638).
- Statistiques de production. Source FAO FishStat.
- Marie Lescroart, Les huîtres. 60 clés pour comprendre, éditions Quæ, , p. 37-43.
- (en) Bruno Cognie, Joël Haure, Laurent Barillé, « Spatial distribution in a temperate coastal ecosystem of the wild stock of the farmed oyster Crassostrea gigas (Thunberg) Author links open overlay panel », Aquaculture, vol. 259, nos 1-4, , p. 249-259 (DOI 10.1016/j.aquaculture.2006.05.037).
- L'utilisation des coquilles broyées comme amendement calcaire est impossible lorsqu'elles proviennent de la prolifération dans les ports en estuaire car elles sont contaminées par des résidus d'hydrocarbures aromatiques polycycliques provenant des carburants des bateaux et des produits chimiques toxiques contenus dans les peintures antifouling.
- (GISD 2008)
- Marie Lescroart, Les huîtres, Éditions Quæ, , p. 39-40
- (en) P. J. Hayward, J. S. Ryland, Handbook of the Marine Fauna of North-West, OUP Oxford, , p. 586
- (en) D.B Quayle, Pacific oyster culture in British Columbia, 1969, the queen’s printer, p. 23
- J. L. Dantec, « Ecologie et reproduction de l’huitre portugaise (Crassostrea angulata Lamarck) dans le bassin d’Arcachon et sur la rive gauche de la Gironde », 1968, vol. 32, no 3, revue des travaux de l’institut des pêches maritimes, p. 237—362
- E. His, « L’émission des gamètes chez l’huître portugaise (Crassostrea angulata LMK) », Revue des Travaux de l’Institut des Pêches Maritimes, vol. 34, no 1, , p. 17—22
- (en) Paul S. Galtsoff, « The American Oyster Crassostrea Virginica Gmelin », Fishery Bulletin, vol. 64, , p. 237
- André Gérard, « Avancées récentes sur la reproduction des huîtres », La pisciculture française, no 134, , p. 71-76 (lire en ligne)
- Marie Lescroart, Les huîtres. 60 clés pour comprendre, éditions Quæ, , p. 47.
- (en) Roger Mann, « Some Biochemical and Physiological Aspects of Growth and Gametogenesis in Crassostrea Gigas and Ostrea Edulis Grown at Sustained Elevated Temperatures », Journal of the Marine Biological Association of the United Kingdom, vol. 59, no 01, , p. 95-110 (DOI 10.1017/S0025315400046208).
- (en) Kohman Y. Arakawa, « Natural spat collecting in the Pacific oyster Crassostrea gigas (Thunberg) », Marine Behaviour and Physiology, vol. 17, no 2, , p. 95-128 (DOI 10.1080/10236249009378760).
- (en) B. Rico-Villa, I. Bernard, R. Robert & S. Pouvreau, « A Dynamic Energy Budget (DEB) growth model for Pacific oyster larvae, Crassostrea gigas », Aquaculture, vol. 305, no v, , p. 87
- Pierre Mollo, Anne Noury, Le Manuel du plancton, ECLM, , p. 101
- Salvi D. et Mariottini P., « Molecular taxonomy in 2D: a novel ITS2 rRNA sequence-structure approach guides the description of the oysters' subfamily Saccostreinae and the genus Magallana (Bivalvia: Ostreidae) », Zoological Journal of the Linnean Society, vol. 179, no 2, , p. 263-276 (DOI 10.1111/zoj.12455, lire en ligne).
- B. L. Bayne, M. Ahrens, S. K. Allen et M. Anglès D'auriac, « The Proposed Dropping of the Genus Crassostrea for All Pacific Cupped Oysters and Its Replacement by a New Genus Magallana: A Dissenting View », Journal of Shellfish Research, vol. 36, no 3, , p. 545–547 (ISSN 0730-8000, DOI 10.2983/035.036.0301, lire en ligne, consulté le )
- (en) Guofan Zhang, Xiaodong Fang, Ximing Guo et Li Li, « The oyster genome reveals stress adaptation and complexity of shell formation », Nature, vol. 490, no 7418, , p. 49–54 (ISSN 1476-4687, DOI 10.1038/nature11413, lire en ligne, consulté le )
- World Register of Marine Species, consulté le 6 janvier 2019
- (en) Ó Foighil1, D., Gaffney, P.M., Wilbur, A.E. & Hilbish, T.J. (1998). Mitochondrial cytochrome oxidase I gene sequences support an Asian origin for the Portuguese oyster Crassostrea angulata. Marine Biology, 131 (3) : 497-503. Résumé
- (en) Reece, K.S., Cordes, J.F., Stubbs, J.B., Hudson, K.L. & Francis, E.A. (2007). Molecular phylogenies help resolve taxonomic confusion with Asian Crassostrea oyster species. Marine Biology, DOI 10.1007/s00227-007-0846-2. Résumé