Lobatus gigas
Strombe géant, Lambi
| Règne | Animalia |
|---|---|
| Embranchement | Mollusca |
| Classe | Gastropoda |
| Ordre | Littorinimorpha |
| Famille | Strombidae |
| Genre | Lobatus |
- Eustrombus gigas
Statut CITES
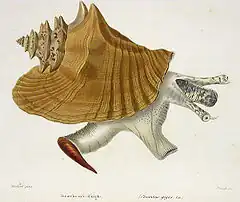
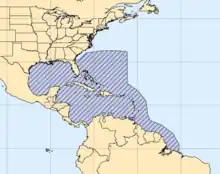
Lobatus gigas (le strombe géant ou lambi) est une espèce de mollusque marin trouvé en zone équatoriale et tropicale de l'Atlantique ouest, notamment aux Antilles et en Floride. Pouvant atteindre 30 cm et 1,5 kg, il consomme des algues et divers débris végétaux. Cette espèce a beaucoup régressé en raison de la surpêche pour la consommation humaine et parfois pour l'usage décoratif de sa coquille. Il est maintenant classé comme espèce menacée et partiellement protégé par la Convention de Washington : commerce fortement limité et placé sous le contrôle des douanes dans les Antilles françaises, par exemple.

Descriptions et biologie





.jpg.webp)
Ce gastéropode muni d’un pied musculeux occupe divers milieux selon son cycle de vie, la saison et l'heure de la journée. Il est réputé détritivore mais peut aussi se nourrir d'algues mortes ou vivantes dérivante (sargasses) ou d'autres débris végétaux apportés par le courant dans les dépressions ou certains fonds marins[1].
 Index Testarum Conchyliorum (1742) de Niccolò Gualtieri
Index Testarum Conchyliorum (1742) de Niccolò Gualtieri Index Testarum Conchyliorum (1742) de Niccolò Gualtieri
Index Testarum Conchyliorum (1742) de Niccolò Gualtieri Index Testarum Conchyliorum (1742) de Niccolò Gualtieri
Index Testarum Conchyliorum (1742) de Niccolò Gualtieri
Répartition
Largement réparti dans l’ensemble des eaux de la Caraïbe, il a été abondamment pêché sur les côtes de Floride et Antilles où il a régressé.
Il peuple potentiellement tout type de fonds situés entre 0 et 100 m de profondeur. L'adulte est préférentiellement présent sur sédiment sablovaseux, entre 4 et 18 m en zone non exploitée par les chaluts et dragues à coquilles. Il est aujourd'hui réputé être plus particulièrement présent au sein des herbiers de phanérogames marines les mieux conservés, mais cette localisation pourrait être un effet indirect de la pression de pêche qu’il subit.
Il est également présent sur les plaines sédimentaires nues, ainsi que sur substrat dur (rocheux ou récifal). Il en serait de même concernant l’existence de stocks âgés situés en plus grande profondeur, de 20 à 60 m[2].
C’est une espèce soumise à de fréquentes migrations, qu'elles soient verticales ou horizontales, qui répondent à des stimuli thermiques et lumineux, et des migrations saisonnières sont identifiées chez les adultes[3]
Les différentes phases de son cycle vital (croissance, maturation, reproduction)
Les juvéniles coloniseraient ainsi préférentiellement les fonds entre 1,5 et 4 m, alors que les adultes préfèrent ceux de 10 à 20 m[4]. Ceci est attesté par le taux de maturité supérieur à 99 % chez les individus rencontrés à partir de 18 m. De septembre à mars, ils se concentrent sur substrat dur, pour rejoindre les herbiers de zones sédimentaires en juillet.
La disponibilité alimentaire ne serait donc pas le principal moteur de ses migrations, comme c’est souvent le cas chez les espèces marines. Le caractère favorable d'un habitat pour ce mollusque semble aussi corrélée à un bon taux de renouvellement de l’eau marine, et à des fluctuations thermiques modérée (saisonnières et journalières).
Alimentation
Lobatus gigas (dénommé lambi dans les Antilles françaises) est un détritivore à tendance herbivore (algues vertes, rouges et brunes). Il se nourrit sur le fond, de débris végétaux et de certaines algues vivantes, avec une préférence pour les sargasses[5].
Les adultes semblent s'alimenter indifféremment de jour comme de nuit, ce qui n’est pas le cas de juvéniles âgés de moins d’un an. Ces derniers mesurant moins de 50 - 100 mm ont encore un mode de vie diurne endogé (enfoui dans le sédiment) et ne remontent pour s’alimenter en surface qu’une fois la nuit tombée[6]. Ce n’est qu’au-delà de cette taille qu’ils iront peupler les herbiers marins peu profonds. Ils y forment de très important agrégats saisonniers et sont alors plus vulnérables aux actions de pêche[7]. C’est là qu’ils acquerront leur forme adulte. L'espèce a fortement régressé dans les Antilles françaises depuis les années 1960, probablement en raison de la surpêche, ce qui a justifié dès la fin des années 1980 des tentatives d'élevage, notamment étudiées par Ifremer[5].
Morphologie
Le lambi est le plus gros des Strombidae de la Caraïbe. Cependant taille et poids observés peuvent varier d’une zone à l’autre. Les spécimens les plus imposants mesurent 24 à 29 cm de long pour 700 à 1 500 g de poids total. Mais la taille moyenne constatée dans pêches est au début du XXIe siècle proche de 20 cm. Les femelles sont légèrement plus grandes que les mâles[8].
Sa coquille est constituée de microcristaux de carbonate de calcium sous forme d'aragonite inclus dans une matrice protéique. Elle est extrêmement solide (beaucoup plus que de simples cristaux d'aragonite) du fait de son architecture composée de couches de lamelles entrecroisées, ce qui permet la dissipation de l'énergie des chocs dans des microfissures qui ne se diffusent pas[9]. Elle possède des spires munies d’épines et son pied musculeux porte un opercule corné. Les mâles sont munis d’un long pénis extensible situé le long du canal siphonal, alors que les femelles portent des poches à œufs. À partir de 5-6 mois, la coquille se colore en rose-orangé. Et dès 3,5 - 4 ans, son large pavillon se forme. Il est également appelé lèvre[10]. L’apparition de la lèvre marque l’approche de la maturité pour le juvénile.
Reproduction
Les individus de 4 ans ayant une taille d’environ 18 cm et 5 mm d’épaisseur de lèvre sont enfin arrivés à maturité[11], ils deviennent alors des reproducteurs. Les adultes présents dans les herbiers (5 à 18 m) ou en bas de la pente récifale (20 à 60 m) vont opérer une migration reproductive saisonnière[12]. Elle va les conduire sur des fonds sédimentaires nus, où accouplements et pontes vont se succéder.
Ce phénomène bien qu’observable tout au long de l’année à Belize et au Mexique, semble se concentrer sur une seule et même période dans d’autres zones. Elle se déroule généralement d’avril à août, alors que la phase dite de repos sexuel s’étend de septembre à mars[13]. Tout au long de cette période, les femelles vont opérer 6 à 25 pontes, chacune représentant à chaque fois entre 300 000 et 1 500 000 œufs[14]. Ces derniers sont rassemblés en un long filament gélatineux de 30 m de long, lui-même aggloméré avec du sable, en un unique croissant de 10 à 15 cm de diamètre[15]. La ponte dure en moyenne 24 à 36 heures. Une même ponte pourra être le fruit de fécondations de différents partenaires[16].
Malgré le nombre de pontes et l’étendue de la saison de reproduction, un pic reproductif a été identifié par diverses études. Il suivrait le maximum de la photopériode et précéderait le maximum de température des eaux. Ce qui le situe approximativement en juillet[17]. Ces mêmes études ont identifié en zones exploitées deux stocks de reproducteurs bien distincts. Le premier regroupant les jeunes adultes présents entre 10 et 18 m se reproduisant alors plus tôt (entre février et octobre suivant la zone) que le second rassemblant les vieux adultes situées plus en profondeur (20 à 60 m) qui se reproduiraient entre avril et août. Ce qui démontre que la pression de pêche conditionnerait la distribution de cette espèce[12]. À l’issue de la saison de reproduction, chaque femelle aura contribué à produire près de 6.106 larves de lambi.
Développement
Lobatus gigas ne compte pas moins de quatre phases de vie distinctes (et une cinquième qui serait un effet indirect de la pression de pêche).
Après trois à quatre jours, les œufs libèrent les larves qui adoptent un mode vie planctonique au sein des 10 premiers mètres de la colonne d’eau. Durant cette phase qui dure deux à cinq semaines, les larves sont soumises aux courants de surface qui les dispersent sur des dizaines voir des centaines de kilomètres. Ce qui peut représenter un transfert de gènes pouvant atteindre un maximum de 900 km[18]. La plupart des larves sont mangées ou meurent durant cette période.
Ensuite la métamorphose survient, si l’ensemble des facteurs favorables nécessaires sont présents. Dans le cas contraire, les larves sont capables de retarder leur métamorphose, mais au risque de perdre définitivement cette compétence indispensable à leur survie[19]. Les larves perdent alors le velum qui leur permettait de se nourrir de microalgues, de respirer et de se mouvoir. Leur coquille s’étant épaissie les jeunes individus tombent sur le fond (1 à 2 m), où ils s’enfouissent. Ils deviennent ainsi des juvéniles[20].
Pendant un an, ils seront enfouis dans le sédiment le jour et remonteront à sa surface pour se nourrir la nuit. À la taille de 50 à 100 mm, les juvéniles d’un an regagnent définitivement la surface et entament une migration ontogénique vers les herbiers de phanérogames marine (entre 1,5 et 5 m). Là ils se rassemblent en agrégats pouvant atteindre 100 m de long sur 2,5 m de large dans certaines régions. Une hypothèse est que ces rassemblements les rendraient moins vulnérables à la prédation[21].
Ils grandissent ainsi jusqu’à l’âge de 3-4 ans correspondant à la formation de la large lèvre, témoignage du passage à l’âge adulte, et migrent alors vers des zones plus profondes (10 à 18 m). Ils colonisent toute sorte de fonds avec toujours une préférence marquée pour les herbiers de phanérogames marines en zone pêchée. Les plus vieux individus observés en zone exploitée semblent par la suite rejoindre des zones encore plus profondes (où ils échappent plus facilement aux pêcheurs). Ils forment alors un stock de reproducteurs âgés et profonds (20 à 60 m), sur lequel repose à l’heure actuelle le repeuplement des zones d’exploitation intense[22].
Ce comportement particulier disparait cependant en l’espace de quelques mois, dans les aires marines protégées quand elles sont non-pêchées, ce qui semble indiquer qu’il s’agit d’une conséquence de la pêche.
La croissance du lambi varie tout au long de ces différentes phases.
Croissance
La croissance du lambi est discontinue et non homogène. Ce qui est à la source de nombreux problèmes concernant la gestion et le suivi des populations. Entre son éclosion et sa métamorphose, le lambi va épaissir et rendre opaque sa coquille. Puis, celle-ci va grandir de manière continue jusqu’à la formation de la lèvre caractéristique du passage à la phase adulte. Dès lors, la coquille ne grandira plus mais va s’épaissir tout comme la lèvre. Mais un processus inverse d’érosion va aussi débuter et prendre de l’ampleur avec l’âge de l’individu[23].
Tout cela, combiné à des variations de croissance dues à la localisation géographique du site de développement, contribue à l’impossibilité d’utiliser la taille ou l’épaisseur des coquilles, pour déterminer l’âge d’un individu. Ceci pose aussi le problème de la taille de première capture censée s’assurer qu’un individu puisse se reproduire avant d’entrer dans le stock exploitable d’une pêcherie. Certains individus présentant une lèvre et mesurant la taille règlementaire peuvent ne pas encore être matures et seront donc pêchés avant de s’être reproduits[23]. De nombreux facteurs environnementaux et biologiques encore mal identifiés semblent donc influencer la croissance des lambis. Mais certains sont déjà bien connus : profondeur, type de substrat, nourriture, densité … Ce sont ces mêmes facteurs qui influencent l’espérance de vie d’un individu.
Mortalité longévité
La mortalité chez Lobatus gigas varie en fonction du stade de développement. S’il est la proie d’environ 130 espèces marines, toutes n’interviennent pas tout au long de sa vie. Ainsi, les organismes planctonophages menacent uniquement la phase planctonique de l’espèce. Les larves de crustacés consomment celles de lambi. C’est également le cas de nombreux organismes comme les méduses, le corail, les gorgones, certains poissons et invertébrés. La métamorphose est également une phase critique de leur développement entrainant de fortes mortalités[23].
Jusqu’à l’âge de 2 ans, les juvéniles sont consommés par les langoustes, les poulpes, d’autres gastéropodes, les poissons, les crabes, ou les bernard l’ermite. Ils se rassemblent alors en agrégats afin de diminuer la pression de prédation[24]. Ensuite, les adultes ne sont plus menacés que par les tortues, les poulpes et les raies. Les plus âgés ont une coquille si épaisse que peu de prédateurs les inquiètent. L’homme est alors le plus grand et le plus efficace de leurs prédateurs[25]. Il en résulte une espérance de vie variable suivant que la population soit exploitée ou non, pouvant osciller entre 6 et 7 ans, en zone peu profonde, contre 26 ans en zone profonde 40 à 60 m[26].
État des populations, menaces

En raison d'une pêche intensive et des mauvais résultats des tentatives d'élevage[5], l'espèce est désormais classé en annexe II de la convention de Washington et en annexe B du règlement européen 338/97, l'exportation de lambis, coquille de lambis ou objets comprenant des morceaux de nacre de lambis est formellement contrôlée et restreinte par les douanes.
Utilisations par l'Homme

Lobatus gigas est dans les Antilles un mets de choix, aussi prisé et luxueux que la langouste. Dans les Antilles Françaises, son appellation gastronomique est « lambi ».
Les populations précolombiennes andines le consommaient et l'utilisaient comme trompe d'appel (« pututo »). Des coquilles sont fréquemment trouvées à proximité de tessons de terre cuite par les archéologues, dont en Martinique[27].
Sa coquille et les perles qu'il peut produire sont utilisées pour la décoration et la confection d'objets comme des bijoux, en particulier la très rare perle rose (une perle rose pour mille lambis environ).
Le Lambi est l'un des symboles du drapeau martiniquais dévoilé le 10 mai 2019[28].
Liens externes
- (fr+en) Référence ITIS : Strombus gigas Linnaeus, 1758
- (en) Référence Animal Diversity Web : Strombus gigas
- (en) Référence NCBI : Strombus gigas (taxons inclus)
- (fr+en) Référence CITES : espèce Strombus gigas Linnaeus, 1758 (+ répartition) (sur le site de l’UNEP-WCMC)
- (en) Référence Fonds documentaire ARKive : Strombus gigas
- Référence Doris (fr)
Annexes
Bibliographie
- AIKEN K. A., KONG G. A., SMIKLE S., MAHON R. & APPELDOORN R., 1999. The Queen Conch fishery on Pedro Bank, Jamaica: discovery, development, management-relationships with recruitment process and population size. Ocean and Coastal Management, Vol. 42 n°.12, p. 1069-1081.
- AIKEN K. A., KONG G. A., SMIKLE S., APPELDOORN R. & WARNER G., 2006. Managing Jamaica’s Queen Conch resources. Ocean and Coastal Management, Vol. 49, p. 332-341.
- ALDANA ARANDA D., BAQUEIRO-CARDENAS E. & MANZANILLA-NAIM S., 2003. Mexican marine parks as a fishery management tool for the Queen Conch Strombus gigas. Proceedings of the Gulf and Caribbean Fisheries Institute, Aldana-Aranda ED., Vol. 55, p. 101-108.
- ANONYME, 1999. Queen Conch stock assessment and management workshop. CFMC & CFRAMP, 105 pages.
- APPELDOORN R. S., 1995. Stock abundance and potential yield of queen conch on Pedro Bank. Fisheries Division, Ministry of Agriculture. Kingston, Jamaica. 31 pages.
- APPELDOORN R. S. & ROLKE W., 1996. Stock abundance and potential yield of the queen conch resource in Belize. CARICOM Fisheries Resource Assessment and Management.
- BASTIDAS C., & RADA M., 1998. Evaluación de las densidades de botuto, Strombus gigas, en zonas especificas del Parque Nacional Archipiélago de Los Roques. Pages 284-287 dans I. Novo, ed. Ciencia y conservación en el sistema de parques nacionales de Venezuela. Caracas. 356 pages.
- BÉNÉ C., & TEWFIK A., 2003. Biological Evaluation of Marine Protected Area: Evidence of Crowding Effect on a Protected Population of Queen Conch in the Caribbean. Marine Ecology, Vol. 24(1), p. 45-58.
- BERG JR. C. J., & OLSEN D. A., 1989. Conservation and management of Queen Conch (Strombus gigas) fisheries in the Caribbean. Marine Invertebrate Fisheries: their assessment and management, p. 421-441.
- BERG JR. C. J., COUPER F., NISBET K., & WARD J., 1992b. Stock assessment of queen conch, Strombus gigas, and harbour conch, S. costatus, in Bermuda. Proceedings of the Gulf and Caribbean Fisheries Institute, Vol. 41, p. 433-438.
- BERG, C. J., JR., & GLAZER R.A., 1995. Stock assessment of a large marine gastropod (Strombus gigas) using randomized and stratified towed-diver censusing. ICES Marine science symposia, Vol. 199, p. 247-258.
- BLANCHET G., GOBERT B., & GUEREDRAT J. A., 2002. La pêche aux Antilles, Martinique et Guadeloupe. IRD Éditions, 299 pages.
- DAVIS J. E., 2003. Population assessment of queen conch, Strombus gigas, in the St. Eustatius marine park, Netherlands Antilles. St. Eustatius Marine Park, 15 pages.
- FRENKIEL L., & ALDANA ARANDA D., 2007. Le Lambi, Strombus gigas. Médiathèque Caraïbe, 19 pages.
- FRIEDLANDER A., APPELDOORN R. S., & BEETS J., 1994. Spatial and temporal variations in stock abundance of queen conch, Strombus gigas, in the U.S. Virgin Islands, p. 51-60 dans R.S. Appeldoorn and B. Rodriguez, eds. Biológica, pesquería y cultivo del caracol Strombus gigas. Fundación Científica Los Roques, Caracas. 356 pages.
- GLAZER R. A., & BERG C. J., 1994. Queen conch research in Florida: an overview, p. 79-95 dans R.S. Appeldoorn and B. Rodriguez, eds. Biológica, pesquería y cultivo del caracol Strombus gigas. Fundación Científica Los Roques, Caracas. 356 pages.
- GLAZER R. A., & KIDNEY J. A., 2004. Habitat association of adult Queen Conch (Strombus gigas) in an unfished Florida Keys back reef: applications to essential fish habitat. Bulletin of Marine Science, Vol. 75(2), p. 205-224.
- GROS D., & FRENKIEL L., 2007. Mise en évidence de parasites du groupe Apicomplexa chez le Lambi Strombus gigas dans l’archipel guadeloupéen et incidence potentielle sur la reproduction. Communication personnelle, 18 pages.
- GUILLOU A. & LAGIN A., 1997. Engins et techniques de pêche de la Martinique. IFREMER DRV RH RST, pages 192-193.
- MATEO I., 1997. Spatial variations in stock abundance of queen conch, Srombus gigas, (Gastropoda: Strombidae) in the West and East coast of Puerto Rico. MC Thesis, Unviversité de Puerto Rico, Mayaguez. 75 pages.
- MEGE S. & DELLOUE X., 2007. Bilan des suivis des herbiers de Phanérogames marines du Grand Cul-de-Sac Marin. Parc National de la Guadeloupe. 56 pages.
- RATHIER I., 1993. Le Stock de lambi (Strombus gigas) en Martinique, analyse de la situation 1986-1987, modélisation de l’exploitation, options d’aménagement. Thèse de doctorat, Université de Bretagne Occidentale, France. 286 pages.
- SCHWEIZER D. & POSADA J. M., 2006. Distribution, density, and abundance of the Queen Conch, Strombus gigas, in Los Roques Archipelago National Park, Venezuela. Bulletin of Marine Science, Vol. 79(2), p. 243-258.
- STONER A. W., 1989. Winter mass migration of juvenile Queen Conch Strombus gigas and their influence on the benthic environment. Marine Ecology Progress Series, Vol. 56, p. 99-104.
- STONER A. W., 2003. What constitutes essential nursery habitat for a marine species? À case study of habitat form and function for Queen Conch. Marine Ecology Progress Series, Vol. 257, p. 275-289.
- STONER A. W., PITTS P. A. & ARMSTRONG R. A., 1996. Interaction of physical factors in the large-scale distribution of juvenile Queen Conch in Seagrass meadows. Bulletin of Marine Science, Vol. 58 (1), p. 217-233.
- STONER A. W., RAY M., GLAZER R. A. & MCCARTHY K. J., 1996. Metamorphic responses to natural substrata in a gastropod larva: decisions related to postlarval growth and habitat preference. Journal of Experimental Marine Biology and Ecology, Vol. 205, p. 229-243.
- STONER A. W. & LALLY J., 1994. High-density aggregation in Queen Conch Strombus gigas: formation, patterns, and ecological significance. Marine Ecology Progress Series, Vol. 106, p. 73-84.
- STONER A. W. & RAY M., 1996. Queen Conch, Strombus gigas, in fished and unfished locations of the Bahamas: effects of marine fishery reserve on adults, juveniles, and larval production. Fishery Bulletin, Vol. 94, p. 551-565.
- STONER A. W., & SANDT V. J., 1992. Population structure, seasonal movements and feeding of queen conch, Strombus gigas, in deep-water habitats of the Bahamas. Bulletin of Marine Science, Vol. 51(3), p. 287-300.
- TEWFIK A., GUZMAN H.M., & GABRIEL J., 1998. Assessment of the queen conch Strombus gigas (Gastropoda: Strombidae) populations in Cayos Cochinos, Honduras. Revista de Biologia Tropical, Vol. 46, p. 137-150.
- THEILE S., 2001. Queen Conch fisheries and their management in Caribbean. TRAFFIC Europe, 96 pages.
- WEIL M. E., & LAUGHLIN R. G., 1984. Biology, population dynamics, and reproduction of the queen conch Strombus gigas Linne in the Archipelago de Los Roques National Park. Journal of Shellfish Research, Vol. 4, p. 45-62.
- WOOD R. S., & OLSEN D. A., 1983. Application of biological knowledge to the management of the Virgin Islands conch fishery. Proceedings of the Gulf and Caribbean Fisheries Institute, Vol. 35, p. 112-121.
Notes et références
- Stoner et Sandt, 1992 ; Stoner et al., 1996 (1 et 2) ; Stoner et Ray, 1996 ; Glazer et Kidney, 2004.
- Stoner et Sandt, 1992 ; Stoner et Ray, 1996 ; Theile, 2001.
- Stoner et al., 1996 (1 et 2) ; Theile, 2001.
- Stoner, 1989 ; Stoner et Sandt, 1992 ; Stoner et al., 1996 (1 et 2) ; Stoner et Ray, 1996 ; Theile, 2001.
- Rathier I (1987) Etat d'avancement des recherches sur l'élevage (en parc, cages (éventuellement en association avec des poissons) ou en herbiers) du Lambi (Strombus gigas) en Martinique.
- (Stoner, 1989 ; Stoner et Sandt, 1992 ; Theile, 2001 ; Frenkiel et Aldana Aranda, 2007)
- (Stoner, 1989 ; Stoner et Lally, 1994 ; Stoner et al., 1996 (1 et 2) ; Theile, 2001 ; Stoner, 2003)
- (Theile, 2001 ; Frenkiel et Aldana Aranda, 2007)
- Ballarini R, Heuer A, Des secrets dans la coquille, Pour la Science, octobre 2008, p86-92
- (anon., 1999 ; Frenkiel et Aldana Aranda, 2007)
- (Berg et Olsen, 1989 ; Stoner, 1989 ; Stoner et Sandt, 1992 ; Stoner et Ray, 1996 ; anon., 1999)
- (Stoner, 1989 ; Stoner et Sandt, 1992 ; anon., 1999 ; Theile, 2001)
- (Berg et Olsen, 1989 ; Stoner et Sandt, 1992 ; anon., 1999 ; Theile, 2001)
- (Stoner et Ray, 1996 ; Theile, 2001 ; Frenkiel et Aldana Aranda, 2007 ; Gros et Frenkiel, 2007)
- (Frenkiel et Aldana Aranda, 2007)
- (Berg et Olsen, 1989 ; anon., 1999 ; Theile, 2001)
- (Stoner et Sandt, 1992)
- (Berg et Olsen, 1989 ; Stoner et Sandt, 1992 ; anon., 1999 ; Theile, 2001 ; Frenkiel et Aldana Aranda, 2007)
- (Stoner et al., 1996 (1 et 2) ; Stoner, 2003)
- (Stoner, 1989 ; Stoner et Sandt, 1992 ; anon., 1999 ; Theile, 2001 ; Frenkiel et Aldana Aranda, 2007)
- (Stoner, 1989 ; Stoner et Lally, 1994 ; Stoner et al, 1996 (1 et 2) ; Theile, 2001 ; Stoner, 2003)
- (Stoner et Sandt, 1992 ; Stoner et Ray, 1996 ; anon., 1999 ; Theile, 2001)
- (anon., 1999 ; Theile, 2001 ; Frenkiel et Aldana Aranda, 2007)
- (Stoner et Lally, 1994 ; Theile, 2001 ; Stoner, 2003)
- (Berg et Olsen, 1989 ; anon., 1999 ; Theile, 2001 ;Frenkiel et Aldana Aranda, 2007)
- (Stoner & Sandt, 1992 ; Stoner & Ray, 1996 ; anon., 1999)
- Antczak, A., de Antczak, M. M. M., Antczak, K., & Antczak, O. (2012). Prospection archéologique sur l’îlet Madame en Martinique. Caracas, Venezuela.
- « La Martinique a désormais son drapeau et son hymne », sur Martinique la 1ère (consulté le )