Juglon
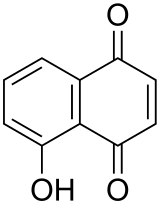
Le juglon est un composé aromatique de formule moléculaire C10H6O3.
| Juglon | |
| |
| Identification | |
|---|---|
| Nom UICPA | 5-hydroxy-1,4-naphtoquinone |
| Synonymes |
C.I. 75500 |
| No CAS | |
| No ECHA | 100.006.880 |
| No CE | 207-567-5 |
| SMILES | |
| InChI | |
| Apparence | poudre cristalline marron[1] ou aiguilles rouge grenat |
| Propriétés chimiques | |
| Formule | C10H6O3 [Isomères] |
| Masse molaire[2] | 174,152 8 ± 0,009 3 g/mol C 68,97 %, H 3,47 %, O 27,56 %, |
| Propriétés physiques | |
| T° fusion | 154 °C[1] |
| Solubilité | soluble dans l'eau chaude,
insoluble dans l'eau froide, très soluble dans l'alcool |
| Cristallographie | |
| Classe cristalline ou groupe d’espace | P1 [3] |
| Paramètres de maille | a = 7,120 Å b = 9,529 Å |
| Volume | 783,07 Å3 [3] |
| Précautions | |
| Directive 67/548/EEC | |
 T |
|
| Transport | |
| Unités du SI et CNTP, sauf indication contraire. | |
On trouve naturellement du juglon, aussi appelé juglone ou juglandine, dans les feuilles, racines et écorce des plantes de la famille des Juglandaceae, et particulièrement dans le noyer noir, mais également dans des Fabaceae et particulièrement dans Biancaea sappan[4]. Il se trouve sous forme libre ou sous forme de 4-β-D-glucopyranoside de l'hydrojuglone (HJG).
Histoire
Les effets néfastes des feuilles de noyers sur d'autres plantes ont été observés depuis au moins deux millénaires. Les civilisations antiques grecques et romaines ont utilisé le noyer pour ses propriétés cytotoxiques tout comme les civilisations sud-américaines pour pêcher facilement les poissons par empoisonnement[5]. Cependant, le juglon n'a pas été isolé chimiquement avant les années 1850. A. Vogel Jr. et C. Reischauer, ont réussi à isoler ce composé (nommé alors nucine) à partir du noyer en 1851. Le Juglon est synthétisé et caractérisé pour la première fois en 1887 par A. bernthsen et A. Semper. Il faudra attendre 1928 pour que ce composé soit confirmé comme étant toxique pour d'autres plantes par E. F. Davis.
Chimie et synthèse
Le Juglon est synthétisé par oxydation du 1,5-dihydroxy naphtalène[6]. Il peut donc être obtenu par oxydations de 5,8-dihydroxy-1-tétralone avec de l'oxyde d'argent, le dioxyde de manganèse, ou la 2.3 dichloro-5,6-dicyano-1,4-benzoquinone (DDQ).
Les données spectrales pour le juglon confirme sa structure bicyclique contenant un groupe hydroxyle, ainsi que deux groupes carbonyle. Le spectre Infra Rouge montre des pics à 3 400 cm-1, 1 662 cm-1 et 1 641 cm-1 qui sont caractéristiques des groupes hydroxyle et carbonyle. [6] La RMN 13C montre 10 pics indiquant le nombre correct d'atome de carbone de la molécule, ainsi que des pics à 160,6 ppm, 183,2 ppm et 189,3 ppm pour le carbone lié au groupe hydroxyle et les deux groupes carbonyle[7].
Effets biologiques
Le juglon est un exemple de composé allélopathique, une substance produite par une plante qui a pour effet de retarder la croissance d'une autre. Les jardiniers ont depuis longtemps remarqué que le jardinage sous ou près des noyers noirs peut être difficile. Cette naphtoquinone est en effet un métabolite secondaire qui correspond à un rhizodépôt allélochimique aux effets phytotoxiques (inhibition de certaines enzymes nécessaires au métabolisme d'autres espèces végétales de la rhizosphère)[8]. Un certain nombre de plantes et d'arbres sont résistants au juglon, dont certaines espèces d'érables (Acer), de bouleau (Betula), et le hêtre (Fagus).
Le juglon est très toxique pour de nombreux insectes herbivores. Certains d'entre eux, cependant, sont capables de dégrader le juglon (et d'autres naphtoquinones connexes) en 1,4,5-trihydroxynaphthalene non toxique.
Utilisations
Le Juglon est parfois utilisé comme herbicide.
Traditionnellement, le juglon a été utilisé comme colorant naturel pour les vêtements et tissus, en particulier la laine, et l'encre. En raison de sa tendance à créer des taches orange-brun foncé, le juglon a donc trouvé une utilisation comme agent colorant pour les aliments et les cosmétiques, comme les colorants capillaires.
Usage médical
L'utilisation de noyer a toujours fait partie de la pharmacopée traditionnelle. En Amérique au début des années 1900, les médecins ont prescrit le juglon pour le traitement de diverses maladies de la peau[9].
L'activité anti-microbienne du Juglon a fait l'objet de recherches[4]
Le juglon a par ailleurs fait l'objet de recherches médicales préliminaires quant à son possible emploi comme agent anticancéreux. Des chercheurs ont récemment émis l'hypothèse que la quercétine et l'acide ellagique que renferment les noix et les feuilles du noyer auraient également des effets anticancéreux.
Notes et références
- Entrée du numéro CAS « 481-39-0 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 21 janvier 2009 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Juglone », sur reciprocalnet.org (consulté le )
- Mi-Youn Lim, Ju-Hyun Jeon, Eun-Young Jeong et Chi-Hoon Lee, « Antimicrobial activity of 5-hydroxy-1,4-naphthoquinone isolated from Caesalpinia sappan toward intestinal bacteria », Food Chemistry, vol. 100, , p. 1254–1258 (DOI 10.1016/j.foodchem.2005.12.009, lire en ligne, consulté le )
- (en) C.J. Soderquist, « Juglone and Allelopathy. », J. Chem. Educ., no 50, , p. 782-783. (doi:10.1021/ed050p782)
- (en) Gerald Booth, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (doi:10.1002/14356007.a17_009.), Naphthalene Derivatives
- (en) O. Suchard, R. Kane, B. J. Roe, E. Zimmermann, C. Jung, P. A. Waske, J. Mattay et M. Oelgemöller, « Photooxygenations of 1-naphthols: an environmentally friendly access to 1, 4 naphthoquinones. », Tetrahedron., no 62, , p. 1467-1473 (doi:10.1016/j.tet.2005.11.021)
- Marc-André Selosse, Les Goûts et les couleurs du monde. Une histoire naturelle des tannins, de l'écologie à la santé, Actes Sud, , p. 71
- (en) M. Strugstad, « A Summary of Extraction, Synthesis, Properties, and Potential Uses of Juglone: A Literature Review », Journal of Ecosystems and Management, no 13 (3), , p. 72–82
