Inversion de l'azote
En chimie, un composé azoté avec une géométrie moléculaire pyramidale trigonale, tel que l'ammoniac, peut subir une rapide inversion de l'azote, c'est-à-dire que la molécule se « renverse »[1].
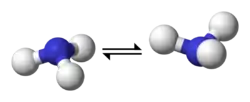 Inversion de l'azote dans l'ammoniac | ||

| ⇌ | 
|
| Inversion d'une amine. Les deux points représentent le doublet non liant sur l'atome d'azote.. | ||
Considérations énergétiques
Cette interconversion est rapide à température ambiante. Deux facteurs contribuent à cette rapidité de l'inversion : une faible barrière énergétique (24,2 kJ·mol-1) et une faible épaisseur de cette barrière, ce qui permet fréquemment un effet tunnel (voir plus bas). Par contraste, la phosphine (PH3) s'intervertit très lentement à température ambiante (barrière énergétique : 132 kJ·mol-1)[2].
Conséquences sur l'isomérie optique
Les amines de type RR′R"N et RR′NH sont chirales, mais il n'est pas possible de les obtenir sous la forme d'un seul énantiomère pur du fait de la rapidité de l'inversion de l'azote sauf cas exceptionnel comme avec les invertomères ; la situation est en revanche très différente pour les sels d'ammonium, RR′R″HN+ et RR′R″R‴N+, ou les amines oxydes, RR′HNO et RR′R″NO, qui sont optiquement stables. De même, les phosphines chirales correspondantes (RR′R″P et RR′PH), les sels de sulfonium (RR′R″S+) et les sulfoxydes (RR′SO) sont optiquement stables.
Effets quantiques
Comme cités plus haut, la transition entre les deux états de l'ammoniac peut se faire par effet tunnel, du fait de la faible épaisseur de la barrière de potentiel[3], et non pas du simple fait de l'agitation thermique. La superposition de ces deux états provoque une séparation des niveaux d'énergie (en) utilisée dans les masers à ammoniac.
Exemples
L'inversion de l'ammoniac fut découverte pour la première fois par spectroscopie micro-onde en 1934[4].
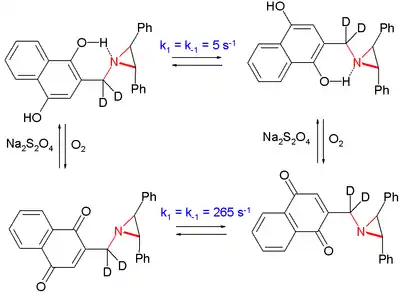
Dans une étude, l'inversion d'une aziridine a été ralentie d'un facteur 50 en plaçant l'atome d'azote dans le voisinage d'une groupe phénolique, en le comparant avec le cas où celui-ci est oxydé en son équivalent hydroquinone[5] :
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Nitrogen inversion » (voir la liste des auteurs).
- Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. (ISBN 0-7506-3365-4).
- Kölmel, C.; Ochsenfeld, C.; Ahlrichs, R. An ab initio investigation of structure and inversion barrier of triisopropylamine and related amines and phosphines. Theor. Chim. Acta. 1991, 82, 271–284. DOI 10.1007/BF01113258
- (en) Richard P. Feynman, The Feynman Lectures on Physics, vol. Volume III, Massachusetts, USA, Addison-Wesley, (ISBN 0-201-02118-8), « The Hamiltonian matrix »
- C.E. Cleeton, « Electromagnetic waves of 1.1 cm wave-length and the absorption spectrum of ammonia », Physical Reviews, vol. 45, no 4, , p. 234–237 (DOI 10.1103/PhysRev.45.234, Bibcode 1934PhRv...45..234C)
- Control of Pyramidal Inversion Rates by Redox Switching Mark W. Davies, Michael Shipman, James H. R. Tucker, and Tiffany R. Walsh J. Am. Chem. Soc.; 2006; 128(44) pp. 14260–14261; (Communication) DOI 10.1021/ja065325f