Hydrure de zirconium(II)
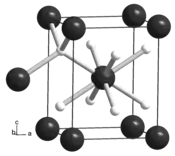
L’hydrure de zirconium(II) est un composé chimique de formule ZrH2. Il s'agit d'un solide gris anthracite pratiquement insoluble dans l'eau. Il se décompose par chauffage au-dessus de 500 °C en libérant de l'hydrogène H2 et du zirconium. Il cristallise dans le système tétragonal selon le groupe d'espace I4/mmm (no 139) avec comme paramètres a = 499,9 pm et c = 443,3 pm[3]. Il est utilisé comme réducteur fort en chimie, en pyrotechnie (notamment dans le domaine militaire), en métallurgie des poudres, comme getter dans les tubes électroniques, pour la production de mousses métalliques et comme modérateur dans les réacteurs nucléaires. Il peut également intervenir dans la production de certaines céramiques.
| Hydrure de zirconium(II) | |
| |
| __ Zr __ H Structure cristalline de l'hydrure de zirconium(II) |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.028.844 |
| No CE | 231-727-3 |
| PubChem | 71317406 |
| Apparence | poudre gris anthracite[1] |
| Propriétés chimiques | |
| Formule | H2Zr |
| Masse molaire[2] | 93,24 ± 0,002 g/mol H 2,16 %, Zr 97,84 %, |
| Propriétés physiques | |
| T° fusion | > 500 °C[1] (décomposition) |
| Masse volumique | 5,61 g/cm3[1] |
| Précautions | |
| SGH[1] | |
 Danger |
|
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Il peut être obtenu dans une composition peu stœchiométrique par réduction du dioxyde de zirconium ZrO2 par de l'hydrure de calcium CaH2 en présence d'hydrogène H2. Une forme stœchiométriquement pure peut être produite à partir d'une mousse de zirconium en présence d'hydrogène à 300 °C. L'absorption d'hydrogène est réversible et s'effectue via les phases ZrH et ZrH1,58–1,67 à ZrH1,67–2,00. On peut également l'obtenir par ablation laser et isolation à basse température[4].
Notes et références
- Entrée « Zirconium hydride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 18 décembre 2022 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Michael V. Glazoff, « Modeling of Some Physical Properties of Zirconium Alloys for Nuclear Applications in Support of UFD Campaign » [PDF], sur https://www.osti.gov/, Laboratoire national de l'Idaho, (consulté le ).
- (en) George V. Chertihin et Lester Andrews, « Reactions of laser-ablated Zr and Hf atoms with hydrogen. Matrix infrared spectra of the MH, MH2, MH3, and MH4 molecules », The Journal of Physical Chemistry, vol. 99, no 41, , p. 15004-15010 (DOI 10.1021/j100041a014, lire en ligne).
