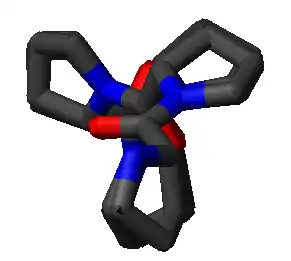
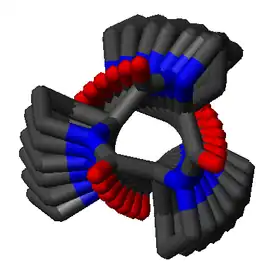
Hélice polyproline
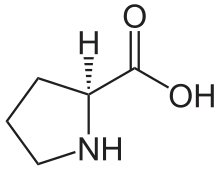
Une hélice polyproline est un type de structure secondaire de certaines protéines présentant une répétition de résidus de proline[1]. Il se forme une hélice polyproline gauche dite de type II, notée PPII, lorsque l'ossature de la suite de résidus présente des angles dièdres (φ, ψ) d'environ (–75°, 150°) et des liaisons peptidiques en configuration trans. Cette conformation PPII se rencontre également dans des polypeptides et des protéines en dehors des hélices polyproline. Il existe également une hélice polyproline droite plus compacte dite de type I, notée PPI, dans laquelle l'ossature de la suite de résidus de proline présente des angles dièdres (φ, ψ) d'environ (–75°, 160°) et des liaisons peptidiques en configuration cis. Parmi les 20 acides aminés rencontrés couramment dans les protéines, seule la proline est susceptible d'avoir une liaison peptidique en configuration cis, notamment la liaison X–Pro ; des effets stériques et effets électroniques favorisent nettement la configuration trans de la plupart des liaisons peptidiques. Cependant, les liaisons peptidiques qui remplacent la proline avec un autre acide aminé N-substitué comme la sarcosine sont également susceptibles d'adopter une configuration cis.
acetic_acid_200.svg.png.webp)
Hélice polyproline de type II
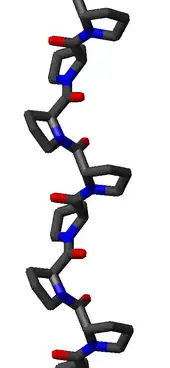
L'hélice polyproline de type II est définie par une ossature ayant des angles dièdres (φ, ψ) d'environ (–75°, 150°) et des liaisons peptidiques en configuration trans. L'angle de rotation Ω par résidu d'une hélice polypeptidique avec des liaisons peptidiques trans est donnée par la relation :
- 3 cos Ω = 1 − 4 cos2 [( φ + ψ ) / 2].
L'application de cette relation avec les valeurs d'angles dièdres (φ, ψ) d'une hélice PPII donne presque exactement Ω = –120°, ce qui correspond à une hélice gauche avec trois résidus par tour d'hélice. La longueur d'hélice par résidu est de l'ordre de 3,1 Å. Cette structure est semblable à celle du collagène, contenant une forte proportion de résidus de proline, d'hydroxyproline et de glycine. Les domaines SH3 (en) se lient spécifiquement aux hélices PPII, ce qui constitue un élément important d'interaction protéine-protéine ainsi qu'au sein d'une même protéine.
L'hélice PPII est relativement ouverte et dépourvue de liaison hydrogène interne, contrairement aux structures secondaires hélicoïdales plus communes telles que l'hélice α, l'hélice 310 et l'hélice π, ou encore l'hélice β.
Les angles dièdres (–75°, 150°) de l'ossature d'une hélice PPII sont fréquemment observés dans les protéines, même avec d'autres acides aminés que la proline[2]. Le diagramme de Ramachandran est fortement peuplé autour de la région PPII, à un niveau comparable à celui de la région du feuillet β, autour de (φ, ψ) = (–135°, 135°). Par exemple, on observe souvent des angles dièdres d'hélice PPII dans les coudes, le plus souvent au niveau du premier résidu d'un coude β (en) de type II. L'image miroir à (75°, –150°) des angles dièdre de l'ossature d'une hélice PPII est rarement observée, hormis dans des polymères de glycine, qui est un acide aminé dépourvu de chiralité. L'analogue en poly-Gly d'une hélice poly-Pro II est appelé hélice poly-Gly II. Certaines protéines, comme la protéine antigel de Hypogastrura harveyi (en), contient des grappes d'hélice poly-Gly II[3].
Hélice polyproline de type I
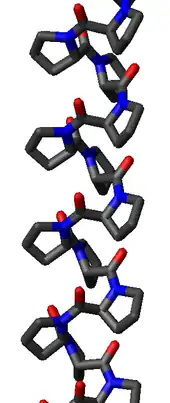
L'hélice polyproline de type I est bien plus dense que l'hélice polyproline II en raison de la configuration cis de ses liaisons peptidiques. Elle est également plus rare que l'hélice PPII car l'enthalpie libre de la configuration cis de son ossature est plus élevée que celle de la configuration trans. Ses angles dièdres typiques sont (–75°, 160°) sont proches mais néanmoins distincts de ceux d'une hélice PPII. L'hélice PPI est cependant une hélice droite plus torsadée, avec environ 3,3 résidus par tour, au lieu de 3 pour une hélice PPII. La longueur d'hélice par résidu est également bien plus faible dans le cas d'une hélice PPI, avec une valeur d'environ 1,9 Å. Comme l'hélice PPII, l'hélice PPI est dépourvue de liaison hydrogène.
Propriétés structurales
L'hélice polyproline II a été traditionnellement considérée comme relativement rigide et a été utilisée comme règle moléculaire en biologie structurale, par exemple pour calibrer des mesures de transfert d'énergie entre molécules fluorescentes. Cependant, des études théoriques et expérimentales subséquentes ont remis en question la conception des hélices polyproline comme des tiges rigides[4] - [5]. Des analyses complémentaires par spectroscopie térahertz (en) et des modélisations selon la théorie de la fonctionnelle de la densité ont souligné que l'hélice polyproline est en réalité bien moins rigide qu'initialement supposé[6].
Les interconversions entre les hélices PPII et PPI sont lentes en raison de l'énergie d'activation élevée de l'isomérisation cis trans de la liaison peptidique, qui est de l'ordre de 80 kJ/mol. Cette interconversion est néanmoins catalysée par des isomérases spécifiques, appelées peptidylprolyl isomérases, ou PPIases.
Notes et références
- (en) Alexei A. Adzhubei, Michael J. E. Sternberg et Alexander A. Makarov, « Polyproline-II Helix in Proteins: Structure and Function », Journal of Molecula Biology, vol. 425, no 12, , p. 2100-2132 (PMID 23507311, DOI 10.1016/j.jmb.2013.03.018, lire en ligne)
- (en) Alexei A. Adzhubei et Michael J. E. Sternberg, « Left-handed Polyproline II Helices Commonly Occur in Globular Proteins », Journal of Molecular Biology, vol. 229, no 2, , p. 472-493 (PMID 8429558, DOI 10.1006/jmbi.1993.1047, lire en ligne)
- (en) Laurie A. Graham et Peter L. Davies, « Glycine-Rich Antifreeze Proteins from Snow Fleas », Science, vol. 310, no 5747, , p. 461 (PMID 16239469, DOI 10.1126/science.1115145, lire en ligne)
- (en) Sören Doose, Hannes Neuweiler, Hannes Barsch et Markus Sauer, « Probing polyproline structure and dynamics by photoinduced electron transfer provides evidence for deviations from a regular polyproline type II helix », Proceedings of the National Academy of Sciences of the United States of America, vol. 104, no 44, , p. 17400-17405 (PMID 17956989, PMCID 2077268, DOI 10.1073/pnas.0705605104, JSTOR 25450247, Bibcode 2007PNAS..10417400D, lire en ligne)
- (en) Mahmoud Moradi, Volodymyr Babin, Christopher Roland, Thomas A. Darden et Celeste Sagui, « Conformations and free energy landscapes of polyproline peptides », Proceedings of the National Academy of Sciences of the United States of America, vol. 106, no 49, , p. 20746-20751 (PMID 19923435, PMCID 2791577, DOI 10.1073/pnas.0906500106, JSTOR 40536068, Bibcode 2009PNAS..10620746M, lire en ligne)
- (en) Michael T. Ruggiero, Juraj Sibik, Roberto Orlando, J. Axel Zeitler et Timothy M. Korter, « Measuring the Elasticity of Poly‐l‐Proline Helices with Terahertz Spectroscopy », Angewandte Chemie International Edition, vol. 55, no 24, , p. 6877-6881 (PMID 27121300, PMCID 4999051, DOI 10.1002/anie.201602268, lire en ligne)