Hélice 310
Une hélice 310 est un type de structure secondaire des protéines susceptible de se former aux extrémités des hélices α ou de manière isolée. Les hélices 310 constituent environ 10 % des domaines hélicoïdaux des protéines globulaires[1]. Il s'agit d'une hélice droite dans laquelle chaque tour d'hélice contient trois résidus d'acides aminés et dix atomes dans les cycles formés par les liaisons hydrogène[2]. Une hélice 310 est ainsi définie par la présence d'une liaison hydrogène entre le groupe NH d'un acide aminé et le groupe CO de l'acide aminé situé trois résidus plus tôt ; la répétition de telles liaisons hydrogène i + 3 → i définit l'hélice 310. Il existe d'autres structures du même type, notamment l'hélice α (liaison hydrogène i + 4 → i) et l'hélice π (liaison hydrogène i + 5 → i).
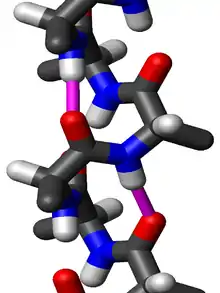
La chaîne polypeptidique est orientée de bas en haut : l'extrémité N-terminale est en bas tandis que l'extrémité C-terminale est en haut ; les chaînes latérales sont quant à elles orientées légèrement vers le bas.
Les résidus le long d'une hélice 310 adoptent des angles dièdres (φ, ψ) voisins de (−49°, −26°). Les hélices 310 sont généralement courtes et s'écartent donc de ces valeurs. De manière plus générale, les résidus le long des hélices 310 adoptent des angles dièdres tels que la somme de l'angle dièdre ψ d'un résidu et de l'angle dièdre φ du résidu voisin vaut environ −75° ; à titre de comparaison, la somme de tels angles vaut environ −105° pour une hélice α et −125° pour une hélice π.
Notes et références
- (en) Claudio Tonlolo et Ettore Benedetti, « The polypeptide 310-helix », Trends in Biochemical Sciences, vol. 16, no 9, , p. 350-353 (PMID 1949158, DOI 10.1016/0968-0004(91)90142-I, lire en ligne)
- (en) Linus Pauling, Robert B. Corey et H. R. Branson, « The structure of proteins: Two hydrogen-bonded helical configurations of the polypeptide chain », Proceedings of the national Academy of Sciences of the United States of America, vol. 37, no 4, , p. 205-211 (PMID 14816373, PMCID 1063337, DOI 10.1073/pnas.37.4.205, JSTOR 88289, Bibcode 1951PNAS...37..205P, lire en ligne)