Hélice bêta
Une hélice β est un élément de structure secondaire des protéines formé par l'association de brins β parallèles disposés de manière hélicoïdale à deux ou trois faces. Il s'agit d'un type de domaine protéique en solénoïde. La structure est stabilisée par des liaisons hydrogène inter-brins, des interactions protéine-protéine et parfois des ions métalliques liés. On a pu observer aussi bien des hélices droites que des hélices gauches.
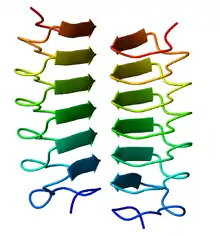

La première hélice β a été observée dans la pectate lyase (en), qui contient une hélice à sept tours de 3,4 nm de long. La protéine des pointes du phage P22 (en) contient une hélice à treize tours et son homotrimère a une longueur de 20 nm ; son intérieur contient des résidus d'acides aminés aussi bien apolaires qu'électriquement chargés formant des liaisons salines ; il est comble et ne présente aucun pore. Ces deux protéines présentent des hélices droites.
Des hélices gauches ont été observées dans l'acyl-ACP-UDP-N-acétylglucosamine O-acyltransférase (en), l'anhydrase carbonique archéenne[1]. Les protéines antigel du ténébrion meunier[2] (hélice droite) et de la tordeuse des bourgeons de l'épinette[3] (hélice gauche), où des résidus de thréonine régulièrement espacés sur les hélices β se lient à la surface des cristaux de glace et inhibent leur croissance, sont d'autres exemples de protéines présentant ce type de structures.
Les hélices β peuvent s'associer efficacement, face-à-face en associant une face de leur prisme à base triangulaire, ou bout-à-bout à l'aide de liaisons hydrogène. Elles peuvent ainsi intervenir comme marqueurs ou étiquettes permettant aux protéines de s'associer entre elles, de façon semblable aux superhélices.
Les protéines à répétition pentapeptidique (PRP) présentent une hélice β quadrilatérale[4].
Notes et références
- (en) C. Kisker, H. Schindelin, B. E. Alber, J. G. Ferry et D. C. Rees, « A left-hand beta-helix revealed by the crystal structure of a carbonic anhydrase from the archaeon Methanosarcina thermophila », The EMBO Journal, vol. 15, no 10, , p. 2323-2330 (PMID 8665839, PMCID 450161)
- (en) Yih-Cherng Liou, Ante Tocilj, Peter L. Davies et Zongchao Jia, « Mimicry of ice structure by surface hydroxyls and water of a β-helix antifreeze protein », Nature, vol. 406, no 6793, , p. 322-324 (PMID 10917536, DOI 10.1038/35018604, lire en ligne)
- (en) Eeva K. Leinala, Peter L. Davies et Zongchao Jia, « Crystal Structure of β-Helical Antifreeze Protein Points to a General Ice Binding Model », Structure, vol. 10, no 5, , p. 619-627 (PMID 12015145, DOI 10.1016/S0969-2126(02)00745-1, lire en ligne)
- (en) Matthew W. Vetting, Subray S. Hegde, J. Eduardo Fajardo, Andras Fiser, Steven L. Roderick, Howard E. Takiff et John S. Blanchard, « Pentapeptide Repeat Proteins », Biochemistry, vol. 45, no 1, , p. 1-10 (PMID 16388575, PMCID 2566302, DOI 10.1021/bi052130w, lire en ligne)