Gènes homéotiques chez les plantes à fleurs
Les gènes homéotiques des plantes à fleurs (ou angiospermes) participent, comme les gènes de développement HOX chez les animaux, à l'organisation des plantes à fleurs. Ils sont conservés chez les différentes espèces et permettent une meilleure compréhension de l'évolution florale.
Origines et découvertes
Si les résultats des études au sujet des gènes Hox des animaux font parler d'eux depuis plusieurs décennies, les découvertes quant aux gènes homéotiques des plantes à fleurs sont elles plutôt récentes. Ce n'est en effet qu'en que paraît l'étude de George W. Haughn et Chris R. Somerville[1] concernant la première version du modèle ABC. Trois ans plus tard, en , c'est au tour d'Enrico S. Coen et d'Elliot M. Meyerowitz[2] de publier leurs résultats. De nombreuses études ont ensuite suivi, précisant les processus menant à la floraison et ses différents acteurs.
Ces expériences, le plus souvent réalisées sur la plante modèle Arabidopsis thaliana, révèlent la nécessité de trois classes de gènes à la floraison : les gènes jouant un rôle dans la spécification du méristème, ceux régissant l'identité des organes et enfin les gènes cadastraux. Deux informations capitales quant au développement des fleurs chez les angiospermes sont dès lors connues : pour qu'ait lieu la floraison, il faudra d'abord que le méristème, à l'origine végétatif, se modifie en méristème d'inflorescences, cela sous l'action de gènes homéotiques ; ce n'est qu'ultérieurement qu'une autre série de gènes homéotiques se chargeront de définir l’identité des organes floraux.
La floraison représente chez la plante le passage à la maturité sexuelle. En effet, la fleur est le siège du système reproductif : les étamines produisent le pollen et le pistil produit l'ovule. C'est pour cette raison que les fleurs ne sont pas produites immédiatement après la germinaison. Plusieurs facteurs endogènes et exogènes doivent préalablement entrer en jeu pour enclencher la transition.
Au niveau des signaux externes il va falloir comme dit précédemment que la plante atteigne un certain âge ; la longueur des journées ainsi que les variations de températures auront elles aussi une influence, l'objectif étant que la floraison ait lieu à une période favorable à la fertilisation future de la plante pour optimiser son succès reproducteur. De même à l'intérieur de celle-ci, des hormones ainsi que plusieurs gènes joueront un rôle capital dans la transition du méristème végétatif en méristème d'inflorescences. À la différence du précédent, le méristème floral permettra la pousse des quatre verticilles de la fleur, de plus sa croissance elle aussi changera et se déterminera : une fois les quatre verticilles établis, la croissance s'arrêtera. Plus tard, selon le modèle ABC, d'autres gènes homéotiques permettront la différenciation et détermineront l'identité des primordias.
Les mutations
Les mutations décrites dans les études de George W. Haughn et Chris R. Somerville ont été obtenues en mettant sous silence des gènes de développement. Ces gènes, codant des facteurs de transcription sont donc ainsi incapables de s'exprimer correctement et ultimement de produire les protéines qui mèneront à la formation des différents types d'organes.
C'est en étudiant ces mutants floraux via l'observation d'oméoses, remplacement d'un organe par un autre, qu'il a été permis d'identifier les trois classes de mutants homéotiques. Chaque mutation aura un impact sur deux vercitiles adjacents :
- dans le cas des mutants A, ce sont les deux premiers verticilles qui sont touchés. Les sépales et pétales sont absents, respectivement modifiées en carpelles et étamines[3].
- pour les plantes mutantes B, ce seront les deuxièmes et troisièmes verticilles qui seront modifiés ; la corolle deviendra le calice et le gynécée l'androcée.
- pour les mutants C, les troisièmes et quatrièmes verticilles seront changés. La transformation des étamines en pétales et des carpelles en sépales sera en effet observable. L'inverse donc des mutants A.
Il a ainsi été possible grâce à ces observations d'identifier trois classes de gènes homéotiques, chacun ayant un impact sur la croissance d'un ou de plusieurs verticilles.
Le modèle ABC
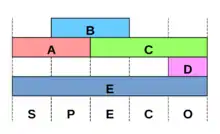
Décrit en par George W. Haughn et Chris R. Somerville, le modèle ABC (en) est celui qui explique les procédés moléculaires et génétiques menant à la différenciation des organes floraux. La fleur se compose de quatre verticilles : le calice, la corolle, l'androcée et le gynécée. Selon ce modèle, l'identité de chacun de ces verticilles est contrôlée par des gènes homéotiques, plusieurs appartenant à la famille de gènes MADS-box. Ils sont regroupés en trois classes, A, B et C dont l'action a un impact sur le premier et second verticilles pour A, le deuxième et troisième verticilles pour B et le troisième et quatrième pour C. Récemment les classes D et E ont été rajoutées. Elles auraient un impact quant à l'ovule pour D et un rôle un peu plus global quant à E dont l'effet s'étend en fait sur les quatre verticilles.
Dans ces classes se retrouvent plusieurs gènes : APETALA1[5], APETALA2, APETALA3[6], PISTILLATA, AGAMOUS, FLORAL BINDING PROTEIN7, FLORAL BINDING PROTEIN1L et SEPALATA3. Ils seront regroupés de telle manière à ce que :
- Classe A : AP1 et AP2
- Classe B : AP3 et PI
- Classe C : AG
- Classe D : FBP7 et FBP1L
- Classe E : SEP3
Au niveau des verticilles, le premier serait codé par AP1 et AP2, le second par la co-expression de AP2, AP3, PI et SEP3, le troisième par celle d'AP3, PI, AG et SEP3 et enfin le quatrième par l'expression de AG et SEP3. Les gènes de la classe A et C étant deux antagonistes mutuels, chez les plantes AP1 et AP2 mutantes (classe A) la fonction de AG s'étendra sur tous les verticilles et inversement.
Pour faire le lien avec les mutations énoncées précédemment, dans le modèle original ABC décrit par George W. Haughn et Chris R. Somerville, les gènes AP1 et AP2 ne seront pas exprimés chez les mutants de type A; AP3 et PI pour les mutants de classe B et finalement AG pour ceux de la classe C.
Les gènes ABC
Les gènes ABC sont des gènes homéotiques qui codent des facteurs de transcription qui ont un rôle dans l'organisation de la fleur. Mis à part AP2 qui ne fait pas partie de la famille MADS-BOX, tous ont un domaine MADS codé par MADS-BOX qui permettra ainsi la liaison à l'ADN sous la forme de dimères. Ils ont de plus un second domaine appelé K qui aura un rôle dans les interactions inter-protéiques. Le domaine MADS est composé d'une séquence de 56 acides aminés dont 9 ont été observés chez tous les membres de la famille.
Fonctionnement
La formation des fleurs implique trois classes de gènes : les gènes de l'identité du méristème, ceux de l'identité des organes et enfin les gènes cadastraux dont le rôle est de réguler spatialement l'expression des gènes de l'identité des organes floraux. Les deux premières classes sont homéotiques, leurs gènes codent ainsi pour des facteurs de transcription qui produisent différentes protéines dont le résultat sera l'organisation florale finale.
Mais avant de pouvoir définir l'identité des organes de la fleur, il faudra d'abord que le méristème végétatif transitionne en méristème d'inflorescences.
Gènes homéotiques influant sur l'identité du méristème
Le méristème des plantes est un tissu spécialisé dans la croissance constitué de cellules souches. Ces cellules d'abord indifférenciées vont se diviser par mitoses et se spécialiser. Le méristème apical caulinaire est celui relatif à la partie aérienne des végétaux : feuilles, tiges, bourgeons, fleurs. Trois gènes homéotiques principaux vont permettre la transition du méristème végétatif en méristème d'inflorescences : APETALA1, LEAFY et AGAMOUS. Le gène LFY code un régulateur de transcription et s'accumule dans les régions périphériques du méristème apical d'inflorescence, cela continuellement dans le développement. Ce gène interagira de manière synergique avec AP1 dont l'ARNm, contrairement à celui de LFY s'accumule tout d'abord de manière diffuse dans les jeunes primordias floraux avant de se restreindre aux deux premiers verticilles dès l'apparition des premières sépales. AP1 jouera aussi un rôle, ultérieurement dans la différenciation des organes des deux premiers verticilles[7].
Les gènes LFY et AP1 codent des facteurs de transcription (spécifique aux plantes pour LFY et MADS-box pour AP1) qui participent à enclencher la différenciation du méristème. Des mutants LFY ou AP1 ne donneront pas de fleur, mais au contraire une expression ectopique de AP1 et LFY enclenchera elle des inflorescences, les plaçant ainsi comme deux gènes clés dans la floraison. D'autres gènes de la famille MADS comme AGAMOUS entreront eux aussi en jeu lors de cette différenciation.
Le gène AG code des facteurs de transcription MADS et a un impact autant sur la croissance et la spécification du méristème végétatif que sur celle des organes floraux au niveau des carpelles et étamines. Sans AG, la croissance du méristème serait indéterminée et produirait des mutants avec un surnombre de pétales. En l'absence d'AG, un méristème d'inflorescence ne sera donc pas totalement spécifié. L'expression d'AG sera contrôlée par LFY et AP1 mais son effet sur la détermination de la croissance du méristème sera indépendant de l'action de ces deux gènes.
Pour résumer, le méristème floral primaire sera d'abord produit par l'action synergique de AP1 et de LFY. Il sera accompagné par l'apparition des pétales et sépales. Plus tard, AG spécifiera la partie plus centrale du méristème. Il a été observé qu'un autre gène, SHOOT MERISTEMLESS (STM), encodant une protéine KNOTTED entrerait en jeu conjointement avec AG pour en définir le domaine d'action.

Gènes homéotiques influant sur l'identité des organes


Maintenant que le méristème est prêt à produire les différents verticilles, c'est au tour des gènes du modèle ABC d'entrer en jeu. La combinaison de ces catégories de gènes permet la spécification des organes. Comme dit précédemment les gènes AP1, AP3, PI, AG, FBP7, FBP1L et SEP3 font partie de la famille gènes MADS, les facteurs de transcription produits par AP2 seront eux de la famille AP2/EREBP. Chacun des verticilles sera le résultat de l'action conjointe d'un ou de plusieurs gènes. Si les premières études ont principalement été réalisées sur la fleur Arabidopsis thaliana, beaucoup d'autres ont été adaptées sur d'autres espèces telles que Antirrhinum majus ou encore Petunia. Les gènes homéotiques retrouvés dans les études seront ainsi souvent des homologues de ceux d'Arabidopsis[8].
Classe A
Chez Arabidopsis thaliana[9], les deux gènes APETALA 1 et APETALA 2 influent sur les deux premiers verticilles. Tout comme AG, AP1 jouera aussi un rôle dans l'identification du méristème. AP2 lui aura en fait un impact sur les quatre verticilles et même sur l'apparition de feuilles. De leur action conjuguée seront produites les sépales et pétales.
Chez Antirrhinum majus[10], les gènes homologues seront respectivement SQUAMOSA (SQUA) pour AP1 ainsi que LIPLESS1 et LIPLESS 2 pour AP2.
Dans le cas de Petunia, de véritables homologues de AP1 n'ont pas encore été clairement identifiés. L'inhibition d'AGAMOUS dans les deux premiers verticilles serait due à l'activité de BLIND. Quant à AP2, trois gènes similaires ont été isolés : PhAP2B, homologue à AP2 autant au niveau de la séquence que dans le patron d'expression ainsi que PhAP2B et PhAP2C.
Classe B
Chez Arabidopsis thaliana[11], les gènes APETALA 3 et PISTILLATA sont responsables de la production des pétales et étamines. Chez Antirrhinum majus, ce sont DEFICIENS (DEF) ET GLOBOSA (GLO) qui se chargeront de la différenciation des seconds et troisièmes verticilles.
Classe C
Chez Arabidopsis thaliana, le gène AGAMOUS est responsable de l'apparition des étamines et des carpelles. Lorsque le gène AG est mis sous silence, l'androcée et le gynécée seront remplacés par des pétales et des sépales. De même, AG ayant un rôle dans la détermination du méristème, celui-ci se développera de manière indifférenciée au niveau du centre de la fleur.
Chez Antirrhinum majus, le gène équivalent à AGAMOUS est PLENA[12]. Récemment, un autre gène, FARINELLI, a été défini comme un second gène du groupe C. Ces deux gènes vont aussi agir de manière redondante dans la prévention de l'expression des gènes du groupe B dans le quatrième verticille.
Chez Petunia, comme chez Antirrhinum majus, le troisième et quatrième verticiles sont contrôlés par plusieurs gènes ayant un patron d'expression similaire. Les homologues d'AG seront pMADS3 et FLORAL-BINDING protein 6 (FBP6).
Classe D
Les gènes FLORAL BINDING PROTEIN7 et FLORAL BINDING PROTEIN1L ont été découverts en 1995. Il a été observé qu'ils auraient un effet sur le développement de l'ovule chez les pétunias. Des gènes équivalent ont aussi été retrouvés chez Arabidopsis thaliana, mais avec un rôle plus important puisqu'ils contrôlent aussi le développement des carpelles en plus de celui de l'ovule. Ils joueraient aussi un rôle dans l'élaboration de structures facilitant la dispersion des graines.
Classe E
Découverts en 1994 lors d'une étude d'interférence par ARN chez les tomates et les pétunias, l'expression de SEP3 est nécessaire dans les quatre verticilles floraux.
Tous les mécanismes de la floraison ne sont pas encore connus mais l'on peut observer la conservation générale d'une sorte de Bauplan floral. Le modèle ABCDE semble en effet être retrouvé chez toutes les espèces, les gènes homéotiques étant homologues entre eux. Aussi, comprendre la phylogénie des gènes homéotiques régulant l'organisation florale tels que ceux de la famille MADS-BOX permet une meilleure compréhension de l'origine et de l'évolution des angiospermes.
Voir aussi
Articles connexes
Notes et références
- (en) George W.H, Chris R.S. “Genetic Control of Morphogenesis in Arabidopsis” Developmental Genetics 9:73-89, 1988
- (en) Enrico S.C, Elliot M.Mm “The war of the whorls: genetic interactions controlling flower developmen t” Nature 353, 31-37, 1991
- (en) « Le Modèle ABC - Acces - Institut Français de l'Éducation »
- (en) « Continuous-time modeling of cell fate determination in Arabidopsis flowers »
- (en) Irish VF1, Sussex IM. “Function of the apetala-1 gene during Arabidopsis floral development.” Plant Cell. 1990 Aug;2(8):741-53.
- (en) Krizek BA1, Meyerowitz EM. “The Arabidopsis homeotic genes APETALA3 and PISTILLATA are sufficient to provide the B class organ identity function.” Development. 1996 Jan;122(1):11-22.
- (en) Lincoln T., Eduardo Z., "Plant Physiology 3rd Edition", Sinauer Associates (2002) (ISBN 0878938230) chap24 p. 560-563
- (en) Lincoln T., Eduardo Z., "Plant Physiology 3rd Edition", Sinauer Associates (2002) (ISBN 0878938230) chap24 p. 563-565
- (en) « TAIR - About Arabidopsis »
- (en) Saedler H, Huijser P. “Molecular biology of flower development in Antirrhinum majus (snapdragon)” Gene. Dec 15;135(1-2):239-43, 1993
- (en) John L.B, David S., Eliott M.M “Genetic Interactions Among Floral Homeotic Genes of Arabidopsis” Development 112, 1-20, 1991
- (en) Brendon D., Patrick M., Emma K., Heinz S., “PLENA and FARINELLI : redundancy and regulatory interactions between two Antirrhinum MADS-box factors controlling flower development” The EMBO Journal, Vol18, No14, p. 4023-4034, 1999