Gène soumis à empreinte
On dit d'un gène qu'il est soumis à l'empreinte parentale lorsque, chez les organismes diploïdes, la copie héritée de la mère et la copie héritée du père ne sont pas exprimées de la même manière. En règle générale, l'une des deux copies du gène est totalement éteinte alors que l'autre est active [1].
Les gènes soumis à l'empreinte parentale sont essentiellement impliqués dans le développement[2]. Aujourd'hui on ne connait des gènes soumis à l'empreinte que chez les mammifères et les plantes à fleur[3].
D'un point de vue moléculaire, l'empreinte parentale est due à l'apposition de marques épigénétiques dans les cellules germinales des parents. Ces marques peuvent par exemple conduire à la répression d'un gène. L'empreinte parentale est due à une différence entre les marques épigénétiques sur la copie d'un gène héritée de la mère et la copie d'un gène héritée du père.
Historique et découverte
Durant les années 1980, des chercheurs montrent qu'un embryon de souris issu artificiellement de la fusion de deux jeux de chromosomes haploïdes issus d'un mâle avorte systématiquement, tandis que les embryons issus de la fusion de deux génomes haploïdes d'une femelle donnent naissance à des jeunes normalement proportionnés mais bien plus petits que la normale[4]. Ceci suggère que les génomes maternel et paternel ne jouent pas le même rôle au cours du développement. C'est ainsi que naît l'idée d'empreinte. Les auteurs proposent déjà, sans idée du mécanisme qui en serait à l'origine, que l'empreinte ait lieu au cours de la gamétogenèse chez les parents. Il apparaît alors que l'empreinte parentale est indispensable au développement normal d'un embryon. C'est quelques années plus tard, au début des années 1990, que les premiers gènes soumis à empreinte parentale sont découverts chez la souris. Il s'agit d'IGF2[5], un facteur de croissance. Les auteurs montrent que les effets d'une mutation sur ce gène sont asymétriques. Un embryon héritant l'allèle sain de la mère et l'allèle muté du père aura un déficit de croissance tandis qu'un embryon héritant de l'allèle muté de la mère et de l'allèle sain du père se développera normalement. Ceci suggère donc que seul l'allèle du gène IGF2 hérité du père est exprimé au cours du développement chez la souris. La découverte d'autres gènes soumis à empreinte chez la souris a très rapidement suivi [6] - [7]. Aujourd'hui on connaît 151 gènes soumis à l'empreinte parentale chez la souris [8], environ 100 chez l'Homme [9] et une douzaine chez les angiospermes[3].
Mécanisme d'apposition de l'empreinte
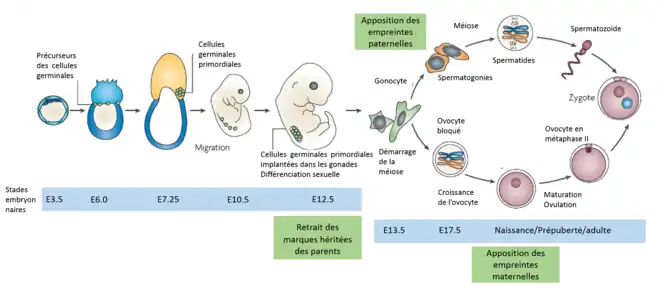
L'empreinte parentale est due à des marques épigénétiques[11], c'est-à-dire des modifications chimiques de l'ADN qui n'affectent pas la séquence codante. Ces modifications sont cependant héritables et peuvent altérer le niveau d'expression de l'information génétique. Parmi ces modifications on trouve la méthylation de l'ADN, la modification des histones (méthylation ou acétylation) et le positionnement des nucléosomes. Les principales marques épigénétiques impliquées dans l'empreinte génétique chez la souris semblent être des méthylations au niveau des îlots CpG (lorsque des nucléotides cytosine et guanine sont adjacents dans la séquence codante)[11], c'est-à-dire l'ajout d'un groupement méthyle (CH3) au niveau d'une cytosine. Les enzymes impliquées dans la méthylation, la déméthylation et la maintenance des méthylations et donc dans le phénomène d'empreinte ont aujourd'hui été identifiées et font partie de la famille des DNA-méthyltransférases (DNMT)[11].
Chez les organismes à reproduction sexuelle on peut généralement distinguer les cellules germinales, cellules participant à la reproduction sexuelle, et les cellules somatiques, toutes les autres cellules d'un individu. Les mécanismes d'empreinte diffèrent généralement entre ces deux tissus. La figure ci-contre présente le cycle de l'empreinte parentale.
- C'est dans les cellules germinales que sont apposées les marques de l'empreinte. Lorsque les cellules germinales sont implantées dans les gonades et que la différenciation sexuelle est initiée (12.5 jours chez la souris), les marques d'empreinte héritées des parents sont effacées. Les nouvelles marques sont apposées au début de la différenciation des cellules sexuelles et donc au cours du développement. La différenciation des sexes autorise alors l'apposition de marques spécifiques, en accord avec le sexe de l'individu. Chez les mâles, les spermatozoïdes porteront des marques différentes des ovules des femelles, c'est ce qui crée le phénomène d'empreinte. L'apposition des marques paternelles a lieu dans les spermatogonies (stade E17.5 du développement de la souris), ces cellules resteront inactives jusqu'à la puberté avant de subir une série de mitoses puis méioses pour donner les spermatozoïdes. Chez les femelles, l'apposition des marques épigénétiques a lieu lors de la croissance des ovocytes primaires[10].
- Si les cellules somatiques subissent des modifications de leurs marques épigénétiques au début du développement, l'empreinte parentale dont elles ont hérité est en général maintenue tout au long de la vie de l'individu[11].
Théorie d'évolution de l'empreinte parentale
L'empreinte parentale apparaît très vite comme un mystère évolutif. En effet, en éteignant une copie d'un gène, les mutations délétères sur la copie exprimée sont plus exposées et peuvent entrainer d'importants coûts de fitness. L'empreinte parentale revient donc à renoncer aux avantages de la diploïdie pour certains gènes[12]. Avant même la découverte du premier gène soumis à empreinte parentale, le premier article s'intéressant à l'histoire évolutive de l'empreinte parentale est publié[13]. Cet article s'intéresse à l'évolution de l'empreinte parentale chez les plantes à fleurs mais la théorie développée peut tout aussi bien s'appliquer aux mammifères. Les auteurs proposent en effet qu'un conflit entre les parents pourrait être à l'origine de l'évolution de l'empreinte parentale. Ils partent de l'hypothèse que la quantité de ressources est limitée, or chez les plantes, comme chez les mammifères, la mère fournit les ressources au fœtus au cours du développement. Ainsi l'intérêt de la mère va être de donner assez de ressource à son descendant pour permettre sa survie et son développement tout en gardant des ressources pour de futurs descendants. Le père en revanche, en particulier dans une population polygyne, n'est pas assuré d'être le père des futurs descendants de la mère. Afin d'augmenter son succès reproductif, il est donc dans son intérêt que son descendant soit le plus résistant possible et donc prenne le plus de ressources possible de la mère. Dans ce contexte ils prédisent que, pour un gène déterminant la quantité de ressources prises hérité du père, la copie héritée de la mère soit complètement réprimée et celle héritée du père complètement exprimée.
On distingue aujourd'hui trois théories majeures pour expliquer l'évolution de l'empreinte parentale[14]:
- Kinship theory ou théorie des conflits de parenté : Selon cette théorie développée principalement par David Haig, on pourrait expliquer l'évolution de l'empreinte parentale par le fait que la copie d'un gène héritée du père et la copie d'un gène héritée de la mère n'ont pas la même valeur sélective inclusive donnant lieu à un conflit sexuel. Il s'agit de la théorie derrière l'article de Haig et Westerbody[13] (décrit ci-dessus) et donc de la première théorie développée. Depuis de nombreux modèles mathématiques ont été développés dans le cadre de cette théorie. Ils montrent que la stratégie évolutivement stable pour un locus soumis à un conflit sexuel est qu'une copie soit complètement éteinte et l'autre complètement exprimée[15].
- Sexual Antagonism Theory : Développée par Bonduriansky et Day[16], cette théorie propose que les copies de gène héritées du père sont plus adaptées au fait d'être mâle alors que les copies héritées de la mère sont plus adaptées au fait d'être femelle. Dans ces conditions, un gène modificateur qui entrainerait l'expression seulement de la copie maternelle d'un gène chez les filles et de la copie paternelle chez les fils permettrait l'évolution de l'empreinte parentale. Dans ces conditions, un conflit sexuel intralocus serait résolu par l'évolution de l'empreinte parentale en autorisant une évolution indépendante des allèles exprimés chez les mâles et chez les femelles. Contrairement à la Kinship theory, les mâles et les femelles ne porteraient pas les mêmes empreintes parentales.
- Théorie de coadaptation mère-descendants : Cette théorie, dont Hager et Wolf sont à l'origine[12], propose que la sélection naturelle peut favoriser une modification du niveau d'expression des gènes hérités de la mère pour permettre une coadaptation de la mère et de son futur descendant au cours du développement chez les êtres vivants à développement interne. Cette théorie prédit que dans la plus grande partie des gènes soumis à empreinte, seule la copie maternelle sera exprimée.
Ces trois théories font des prédictions très précises sur les types de gènes qui pourraient être soumis à l'empreinte ainsi que leur patron d'expression, mais les données expérimentales disponibles à ce jour ne sont pas encore assez précises pour pouvoir trancher entre les différentes hypothèses. Dans tous les cas, ces trois théories ne sont pas exclusives et il est fort probable que plusieurs puissent être appliquées simultanément. Certains auteurs[17] font une distinction entre la théorie forte qui permet d'expliquer l'apparition de l'empreinte ainsi que son maintien et son développement et la théorie faible qui ne permet d'expliquer que son développement. Ainsi selon le principe de parcimonie, il est fort probable qu'une seule théorie soit forte et explique l'apparition de l'empreinte parentale, mais une fois le phénomène apparu, différentes théories peuvent surement expliquer son développement à différents loci.
Empreinte chez les insectes
L'empreinte génétique a été décrite pour la première fois chez le diptère Sciara, où l'extinction génique (ou absence d'expression) de la copie paternelle est impliquée dans le déterminisme du sexe[18].
Empreinte chez l'homme et aspects médicaux
Le bon fonctionnement du gène nécessite à la fois le gène maternel et le gène paternel. La plupart des gènes soumis à empreinte sont localisés sur les chromosomes 6, 7, 11, 14 et 15. La connaissance des gènes soumis à empreinte permet de comprendre certaines maladies génétiques et permet un conseil génétique pertinent. Ainsi, la disparition de la version du gène ou locus d'un des parents par délétion ou disomie uniparentale avec présence de deux copies de même origine est responsable de :
Empreinte chez les plantes à fleur
Chez les plantes à fleurs, une dizaine de gènes sous empreinte ont été identifiés chez Arabidopsis thaliana et Zea mays[19].
Lien externe
Notes et références
- (en) Marisa S. Bartolomei et Shirley M. Tilghman, « Genomic imprinting in mammals », Annual Review of Genetics, Annual Reviews, Inc., vol. 31, , p. 493-526 (lire en ligne)
- (en) Miguel Constância, Gavin Kelsey et Wolf Reik, « Resourceful imprinting », Nature, vol. 432, , p. 53–57 (ISSN 0028-0836, DOI 10.1038/432053a, lire en ligne, consulté le )
- Robert Feil et Frédéric Berger, « Convergent evolution of genomic imprinting in plants and mammals », Trends in Genetics, vol. 23, , p. 192–199 (DOI 10.1016/j.tig.2007.02.004, lire en ligne, consulté le )
- M. A. Surani, S. C. Barton et M. L. Norris, « Development of reconstituted mouse eggs suggests imprinting of the genome during gametogenesis », Nature, vol. 308, , p. 548–550 (ISSN 0028-0836, PMID 6709062, lire en ligne, consulté le )
- Thomas M. DeChiara, Elizabeth J. Robertson et Argiris Efstratiadis, « Parental imprinting of the mouse insulin-like growth factor II gene », Cell, vol. 64, , p. 849–859 (DOI 10.1016/0092-8674(91)90513-X, lire en ligne, consulté le )
- Kimberly D. Tremblay, Jennifer R. Saam, Robert S. Ingram et Shirley M. Tilghman, « A paternal–specific methylation imprint marks the alleles of the mouse H19 gene », Nature Genetics, vol. 9, , p. 407–413 (ISSN 1061-4036, DOI 10.1038/ng0495-407, lire en ligne, consulté le )
- (en) D. P. Barlow, R. Stöger, B. G. Herrmann et K. Saito, « The mouse insulin-like growth factor type-2 receptor is imprinted and closely linked to the Tme locus », Nature, vol. 349, , p. 84–87 (DOI 10.1038/349084a0, lire en ligne, consulté le )
- (en) Williamson CM, Blake A, Thomas S, Beechey CV, Hancock J, Cattanach BM, and Peters J, « Mouse Book imprinted Loci », sur www.mousebook.org, (consulté le )
- « Geneimprint : Genes », sur www.geneimprint.com (consulté le )
- (en) Hiroyuki Sasaki et Yasuhisa Matsui, « Epigenetic events in mammalian germ-cell development: reprogramming and beyond », Nature Reviews Genetics, vol. 9, , p. 129–140 (ISSN 1471-0056, DOI 10.1038/nrg2295, lire en ligne, consulté le )
- (en) Suhua Feng, Steven E. Jacobsen et Wolf Reik, « Epigenetic Reprogramming in Plant and Animal Development », Science, vol. 330, , p. 622–627 (ISSN 0036-8075 et 1095-9203, PMID 21030646, PMCID 2989926, DOI 10.1126/science.1190614, lire en ligne, consulté le )
- Jason B. Wolf et Reinmar Hager, « A Maternal–Offspring Coadaptation Theory for the Evolution of Genomic Imprinting », PLOS Biol, vol. 4, , e380 (ISSN 1545-7885, PMID 17105351, PMCID 1635750, DOI 10.1371/journal.pbio.0040380, lire en ligne, consulté le )
- David Haig et Mark Westoby, « Parent-Specific Gene Expression and the Triploid Endosperm », The American Naturalist, vol. 134, , p. 147–155 (lire en ligne, consulté le )
- (en) M. M. Patten, L. Ross, J. P. Curley et D. C. Queller, « The evolution of genomic imprinting: theories, predictions and empirical tests », Heredity, vol. 113, , p. 119–128 (ISSN 0018-067X, PMID 24755983, PMCID 4105453, DOI 10.1038/hdy.2014.29, lire en ligne, consulté le )
- (en) David Haig, « Parental antagonism, relatedness asymmetries, and genomic imprinting », Proceedings of the Royal Society of London B: Biological Sciences, vol. 264, , p. 1657–1662 (ISSN 0962-8452 et 1471-2954, PMID 9404029, PMCID 1688715, DOI 10.1098/rspb.1997.0230, lire en ligne, consulté le )
- (en) Troy Day et Russell Bonduriansky, « Intralocus Sexual Conflict Can Drive the Evolution of Genomic Imprinting », Genetics, vol. 167, , p. 1537–1546 (ISSN 0016-6731 et 1943-2631, PMID 15342496, PMCID 1470977, DOI 10.1534/genetics.103.026211, lire en ligne, consulté le )
- (en) Jon F. Wilkins et David Haig, « What good is genomic imprinting: the function of parent-specific gene expression », Nature Reviews Genetics, vol. 4, , p. 359–368 (ISSN 1471-0056, DOI 10.1038/nrg1062, lire en ligne, consulté le )
- Crouse, H. V., 1960. The Controlling Element in Sex Chromosome Behavior in Sciara. Genetics 45, pp 1429-1443.
- Feil, R. et Berger, F. 2007. Convergent evolution of genomic imprinting in plants and mammals. Trends in Genetics 23, pp 192-199. DOI 10.1016/j.tig.2007.02.004