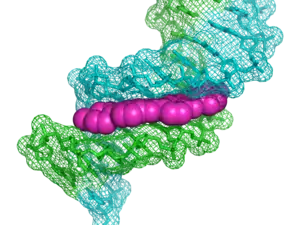
Coloration Hoechst
Les colorants Hoechst font partie de la famille des colorants à l'aide de marqueurs fluorescents utilisés pour marquer l'ADN. Ces composés, de la famille des bisbenzimides, ont été initialement développés par Hoechst AG qui numérotait ses créations. Ainsi, le Hoechst 33342 est le composé no 33342 développé par cette entreprise. Il existe trois composés similaires de coloration de l'ADN : le Hoechst 33258, le Hoechst 33342 et le Hoechst 34580. Les colorants Hoechst 33258 et Hoechst 33342 sont les plus fréquents et possèdent des spectres d'excitation/émission similaires. Le Hoechst 33342 a une perméabilité cellulaire dix fois plus grande que le H33258.

Caractéristiques moléculaires
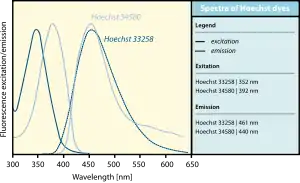
Les deux composés s'excitent à l'aide de rayons ultraviolet à une longueur d'onde autour de 350 nm, ils émettent tous deux une lumière bleu-cyan par fluorescence. La longueur d'onde d'émission maximum est à 461 nm. Lorsqu'il est non-lié, le colorant émet son maximum de fluorescence entre 510 et 540 nm. La coloration Hoechst peut être excitée par une lampe à xénon ou une lampe à vapeur de mercure ou par un laser UV. Le déplacement de Stokes entre le maxima d'excitation et d'émission rend la coloration Hoechst très utile dans des expériences où un grand nombre de fluorophores sont utilisés. L'intensité de fluorescence de la coloration Hoechst augmente avec le pH du solvant[1].
Les colorants Hoechst sont soluble dans l'eau et dans les solvants organiques comme le diméthylformamide ou le diméthylsulfoxide. On peut obtenir des solutions jusqu'à une concentration de 10 mg/mℓ. Les solutions aqueuses sont stable plus de six mois si stockées entre 2 et 6 °C et protégées de la lumière. Pour des conservations plus longues, les solutions sont congelées à une température inférieure à −20 °C[1].
Le colorant se fixe au niveau du petit sillon du double-brin d'ADN avec plus d'affinité pour les séquences riches en adénine et thymine. Une fixation sur ces séquences riches en AT augmente considérablement la fluorescence obtenue[3]. La coloration Hoechst est perméable aux cellules : elle permet de marquer les cellules vivantes fixées.
Utilisations
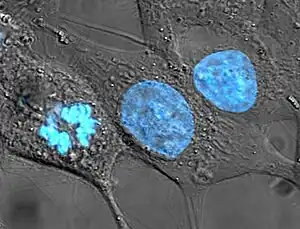
On utilise généralement une concentration comprise entre 0,1 et 12 µg/mℓ pour la coloration de cellules eucaryotes ou procaryotes. Le marquage prend de une à trente minutes à température ambiante ou à 37 °C, puis les cellules sont rincées. Une fluorescence verte, correspondant à du colorant non-lié, peut être observée si trop de composé a été utilisé ou si l'échantillon n'a pas été rincé convenablement[1]. La coloration Hoechst est souvent utilisée comme alternative à un autre colorant d'acide nucléique : le DAPI.
Différences principales entre les colorants Hoechst et DAPI :
- les colorants Hoechst sont moins toxiques que le DAPI[4] ;
- les colorants Hoechst possèdent un groupe éthyle leur permettant de traverser plus librement les membranes cellulaires ;
Les colorants Hoechst 33342 et 33258 sont désactivés (« quenché » en franglais de laboratoire, [kwenche] en phonétique) par la bromodéoxyuridine (BrdU), qui est très utilisée pour détecter les cellules en division. Ces dernières intègrent le BrdU dans l'ADN néo-synthétisé à la place de la thymidine. Lorsque le BrdU est incorporé à l'ADN, on suppose que le groupement bromure déforme le petit sillon de la double hélice et empêche le colorant Hoechst d'atteindre son site de fixation optimal. Le colorant Hoechst peut être utilisé en même temps que le BrdU pour suivre la progression du cycle cellulaire[5] - [6].
On utilise souvent les colorants Hoechst pour colorer l'ADN génomique dans les cas suivants :
- en microscopie à fluorescence et immunohistochimie, souvent en même temps que des fluorophores[7] ;
- en cytométrie en flux pour compter le nombre de cellules. Regarder les populations de cellules dans les différentes phase du cycle cellulaire est une utilisation classique[8] ;
- pour la visualisation d'ADN en présence d'ARN dans les gels d'agarose[9] ;
- pour la détection et la quantification automatique de l'ADN dans un échantillon[10] ;
- pour le tri de chromosome[9].
Toxicité et sécurité
Du fait de sa fixation à l'ADN, ces colorants interfèrent avec la réplication de l'ADN pendant la division cellulaire. Par conséquent, ils sont potentiellement mutagènes et cancérigènes, il faut donc respecter un certain nombre de règles lors de leur manipulation et de leurs traitements comme déchets. La coloration Hoechst est utilisée pour trier le sperme dans le cas de stocks humains. Sa sûreté a été débattue[11] - [12].
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Hoechst stain » (voir la liste des auteurs).
- « Hoechst Stains », Invitrogren (Molecular Probes)
- 264D
- J Portugal et Waring, MJ, « Assignment of DNA binding sites for 4',6-diamidine-2-phenylindole and bisbenzimide (Hoechst 33258). A comparative footprinting study », Biochimica et Biophysica Acta, vol. 949, no 2, , p. 158–68 (PMID 2449244, DOI 10.1016/0167-4781(88)90079-6)
- (en) BD Bioscience, Techniques for Immune Function Analysis, Becton, Dickinson and Company, , 2e éd. (lire en ligne)
- M Kubbies et Rabinovitch, PS, « Flow cytometric analysis of factors which influence the BrdUrd-Hoechst quenching effect in cultivated human fibroblasts and lymphocytes », Cytometry, vol. 3, no 4, , p. 276–81 (PMID 6185287, DOI 10.1002/cyto.990030408)
- SY Breusegem, Clegg, RM et Loontiens, FG, « Base-sequence specificity of Hoechst 33258 and DAPI binding to five (A/T)4 DNA sites with kinetic evidence for more than one high-affinity Hoechst 33258-AATT complex », Journal of Molecular Biology, vol. 315, no 5, , p. 1049–61 (PMID 11827475, DOI 10.1006/jmbi.2001.5301)
- (en) Molecular Probes Handbook : A Guide to Fluorescent Probes and Labeling Technologies, Iain Johnson, Michelle T.Z. Spence, , 11e éd., 1060 p. (ISBN 978-0-9829279-1-5 et 0-9829279-1-6)
- M Kubbies, « Flow cytometric recognition of clastogen induced chromatin damage in G0/G1 lymphocytes by non-stoichiometric Hoechst fluorochrome binding », Cytometry, vol. 11, no 3, , p. 386–94 (PMID 1692786, DOI 10.1002/cyto.990110309)
- R Mocharla, Mocharla, H et Hodes, ME, « A novel, sensitive fluorometric staining technique for the detection of DNA in RNA preparations », Nucleic Acids Research, vol. 15, no 24, , p. 10589 (PMID 2447564, PMCID 339970, DOI 10.1093/nar/15.24.10589)
- W Sterzel, Bedford, P et Eisenbrand, G, « Automated determination of DNA using the fluorochrome Hoechst 33258 », Analytical Biochemistry, vol. 147, no 2, , p. 462–7 (PMID 2409841, DOI 10.1016/0003-2697(85)90299-4)
- M.J. Ashwood-Smith, « Safety of human sperm selection by flow cytometry », Oxford University Press, vol. 9, no 5, , p. 757–759 (PMID 7929716, lire en ligne)
- I Parrilla, J M Vázquez, C Cuello, MA Gil, J Roca, D Di Berardino et EA Martínez, « Hoechst 33342 stain and u.v. laser exposure do not induce genotoxic effects in flow-sorted boar spermatozoa », Reproduction, vol. 128, no 5, , p. 615–621 (PMID 15509707, DOI 10.1530/rep.1.00288, lire en ligne)
Liens externes
- (en) Manuel d'utilisation des colorants Hoechst [PDF], sur probes.invitrogen.com