Coévolution dans les interactions prédateur-proie
La coévolution dans les interactions prédateurs-proies est une sous-catégorie de coévolution antagoniste qui s’intéresse aux adaptations réciproques de deux espèces, ou plus de deux espèces, dues aux pressions de sélection exercées entre elles dans le cadre de la prédation. Ainsi, les proies vont développer de multiples adaptations leur permettant de mieux échapper ou résister aux prédateurs qui vont alors développer des contre-adaptations leur permettant de mieux les repérer ou les capturer. Il existe plusieurs modèles de coévolution proies-prédateurs mais ces derniers ne sont pas généralisables à l’ensemble des situations retrouvées dans la nature et ne sont pour la plupart pas empiriquement prouvés. Ces modèles varient aussi en fonction des scénarios incluant plusieurs proies, plusieurs prédateurs, super prédateurs.
.jpg.webp)
Difficultés dans le domaine
Différents modèles
Pour tenter de comprendre les phénomènes de coévolution, les chercheurs ont utilisé différents modèles basés sur des observations scientifiques des mécanismes naturels mais également en faisant des hypothèses sur certains paramètres de ces modèles.
Ces modèles varient donc en complexité et dans leur capacité à refléter la réalité. En effet, l’évolution des traits impactés par la prédation chez les prédateurs et les proies s’est avérée difficile à comprendre en théorie et également à étudier sur le terrain. Ainsi les évidences physiques permettant d'appuyer ou de réfuter les différents modèles sont rares. Qui plus est, la démonstration de la véracité d'un modèle au sein d'un environnement et pour un couple d'espèces donné n'atteste pas de sa véracité universelle. Ainsi les différents modèles exposés ici font encore l'objet de débats au sein de la communauté scientifique et ne peuvent être jugés comme vérités absolues[1].
Étude des données fossiles
L'évolution des traits phénotypiques s'effectuant sur de longues périodes de temps, il serait possible de comparer des fossiles de proies et de prédateurs situés dans une même zone géographique. Cependant les données fossiles sont difficiles à interpréter, en effet il n'est pas possible de prendre en compte des réponses évolutives comportementales de la part des prédateurs en fonction des défenses développées par les proies, ainsi que les autres caractéristiques qui ne sont pas visibles sur les fossiles.
Modèles de coévolution
Course à l'armement
La coévolution proie-prédateur a souvent été décrite en utilisant l’analogie de la course aux armements. Celle-ci intervient dans des situations de coévolution où une espèce met en place des stratégies adaptatives en réponse à celles développées par une autre espèce avec laquelle elle interagit[2] - [3].
Il en existe plusieurs types. Ainsi, une course aux armements peut être intraspécifique, comme dans le cas de la compétition intraspécifique, ou interspécifique, comme les interactions proies-prédateurs ou hôtes-parasites. Elle peut également être symétrique ou asymétrique. Dans le cas d’une course aux armements symétrique, les parties évoluent de la même façon en réponse à des pressions de sélection identiques. Au contraire, dans le cas d’une course aux armements asymétrique, les pressions de sélection sont inégales pour les deux parties ; l’une va ainsi développer des adaptations offensives tandis que l’autre va développer des adaptations défensives[2].
La coévolution proie-prédateur implique des pressions de sélection inégales pour les proies et pour les prédateurs : c’est un exemple classique de course aux armements interspécifique et asymétrique. Si la pression de sélection est plus forte sur l’une des espèces, alors celle-ci aura tendance à être avantagée. La prédation du renard sur le lapin est un exemple de ce phénomène : « le lapin court plus vite que le renard, car le lapin court pour sa vie, alors que le renard court pour son dîner » (Dawkins, 1979). En effet, un renard qui n’a pas réussi à attraper sa proie peut encore se reproduire ; il va mourir de faim s’il échoue trop souvent à attraper des proies, mais il y a toujours une possibilité qu’il se reproduise avant. Au contraire, un lapin n’a aucune chance de se reproduire après avoir perdu une course contre un renard[2].
Une course aux armements peut finir de quatre façons différentes :
- Une des parties peut s’éteindre (par exemple, le prédateur peut chasser sa proie jusqu’à l’extinction) ;
- Une des parties peut atteindre un optimum ;
- Les deux parties peuvent atteindre un optimum local ;
- La course peut se poursuivre en un cycle sans fin[2].
Hypothèse de la reine rouge

La course aux armements entre espèces est symbolisée par l’Hypothèse de la Reine Rouge, émise par Leigh Van Valen (1973). Elle tient son nom d’un passage de De l’autre côté du miroir (suite d’Alice au Pays des Merveilles) de Lewis Carroll, dans lequel Alice, engagée dans une course effrénée avec la Reine Rouge, constate qu’elles n’avancent pas. La Reine lui répond alors : « Ici, vous voyez, il faut courir le plus vite possible pour rester au même endroit ». Ainsi, le prédateur développe des adaptations qui le rendent meilleur pour attraper des proies, mais cela ne signifie pas qu’il en attrape plus, car la proie aussi devient meilleure pour lui échapper. Le rapport de force entre proie et prédateur reste donc inchangé au cours du temps[4].
Remise en question de la théorie
La pertinence de l’analogie de la course aux armements est cependant remise en question. En effet, l’analyse de différents modèles mathématiques a montré que des populations de proies et de prédateurs n’entrent pas forcément dans une course aux armements. Cette analogie n’est donc pas généralisable à la coévolution proies-prédateurs dans son ensemble. De plus, les proies et les prédateurs ne répondent pas de la même manière aux adaptations de l’autre : les réponses adaptatives des proies sont plus fréquentes que celles des prédateurs[3].
Coévolution stable système bidirectionnel cyclique
Certains modèles décrivent la coévolution comme un cycle basé sur l'évolution d'un trait des proies sur un axe bidirectionnel. Les proies peuvent développer ce trait ou au contraire le diminuer. En prenant l'exemple des défenses contre le prédateur, elles peuvent gagner de meilleures défenses ou en perdre, entraînant une évolution adaptative du prédateur qui pourra développer de meilleurs traits d'attaque.
On considère dans ce modèle que développer un trait a un coût comme le maintien d'une plus grande masse musculaire. Au fil du temps, le coût de maintien et de développement d'un trait extrême chez la proie ralentit le développement de ce trait et permet au prédateur de développer un trait offensif surpassant les défenses des proies.
Ces défenses coûteuses deviennent limitantes, une forte pression de sélection s'applique sur ces proies dont les traits diminuent jusqu'à des niveaux faibles, avec les traits d'attaque des prédateurs qui deviennent superflus et diminuent également. Finalement, il redevient favorable pour les proies de développer des traits défensifs quand les traits offensifs des prédateurs ont assez diminué, perpétuant ainsi une forme de course à l'armement circulaire[1].
Malgré le fait que beaucoup d'études utilisent un axe bidirectionnel dans leur modèle de coévolution, aucune étude sur le terrain n'a pu démontrer empiriquement sa véracité. Seul le constat de la sélection de la taille des proies par les prédateurs, évitant les individus trop petits ou trop grands, donne un élément supportant cette théorie dans le cas où les écarts de taille sont suffisants pour impacter la survie des proies[1].
Coévolution en Mosaïque géographique
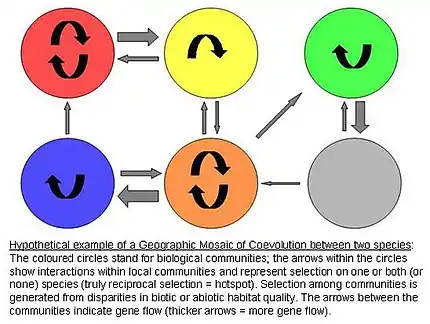
La mosaïque géographique est une approche de l’étude de la coévolution basée sur la différence de sélection de certains traits en fonction des conditions spécifiques des différentes régions où se situent les individus. Elle part du constat de John N. Thompson[5] - [6], selon lequel ce sont les interactions écologiques et comportementales entre les individus qui génèrent leur sélection réciproque et qui conduisent à la coévolution.
Les différents habitats et conditions de cohabitation entre les prédateurs et les proies créent des points chauds où la coévolution entre les deux espèces est forte ainsi que des points froids où elle est faible. Certains des résultats prévus de cette mosaïque de coévolution sont l'apparition de phénotypes mal adaptés ou mal appariés, le maintien de niveaux élevés de polymorphisme et la prévention de combinaisons de caractères d’équilibre stables[4].
Un exemple soutenant les prédictions générales de cette théorie est l’étude d’Edmund D & Al 2002, étudiant la coévolution de Thamnophis sirtalis, une espèce de vipère, et sa résistance aux tétrodotoxines (TTX) sécrétées par sa proie, un triton du genre Taricha. Les résultats démontrent une résistance mille fois supérieure entre les vipères de certaines populations et ce malgré le fait que ces populations soient faiblement espacées[4].
Stratégies développées par les proies
Coévolution des proies nocives et inoffensives
_Edit.jpg.webp)
Pour survivre face à un prédateur, les proies peuvent développer différentes stratégies telles que l’aposématisme (émission d’un signal d’avertissement associé à la nocivité de la proie), le mimétisme batésien (une espèce imite le signal d’avertissement d’une espèce aposématique) ou encore la possibilité de s’agréger.
Ces stratégies peuvent faire intervenir deux espèces de proies qui, pour maintenir leurs fitness respectifs, vont coévoluer. Certaines proies, dites défensives (comme les dendrobates), possèdent des défenses importantes face à leurs prédateurs alors que d’autres, dites non-défensives (offensives, inoffensives, vulnérables ou non défendues), sont plus vulnérables[7].
Aposématisme
Dans le cas où l'on retrouve un système proie-prédateur composé de proies dites défensives et de proies dites non défensives, l'une des stratégies pouvant entrer en jeu est l'aposématisme. Cette stratégie est notamment utilisée par les proies défensives afin de favoriser l'apprentissage des prédateurs et favoriser un évitement de ce type de proie du fait de leur visibilité. Toutefois, une théorie rivale (soutenue notamment par Fischer en 1930 et expérimentée par Sherratt et Beatty en 2003), indique que cette stratégie n'est pas utilisée afin de réaliser un effet d’apprentissage sur les prédateurs, mais pour se distinguer des proies vulnérables. Il semble en effet que la coévolution spécifique aux proies défensives est ici favorisée, notamment pour deux espèces cryptiques où la proie défensive, similaire à la proie non défensive, va plus avoir tendance à être attaquée que lorsqu'elle est bien distincte. Les proies défensives vont donc évoluer pour se différencier des proies non défensives[7].
Mimétisme batésien
.jpg.webp)
La théorie de Fischer semble se révéler juste notamment dans l'étude de la stratégie de mimétisme batésien. En effet, lorsque des proies offensives ressemblent à des proies nocives, les expériences menées par Sherratt et Beatty révèlent que les prédateurs semblent différencier un usurpateur d'une proie aposématique. Cela induit une mutation des espèces nocives afin de continuer à se différencier des proies non défensives en augmentant leur visibilité, leur taille ou en étant plus lentes par exemple. Il semble donc que le mimétisme fonctionne si le système est également composé de proies inoffensives cryptiques, favorisées par les prédateurs pour éviter les proies visibles, qu'elles soient défensives ou non. Toutefois dans le cas où les prédateurs sont confrontés à deux espèces visibles, ces derniers reconnaîtront majoritairement les proies non défensives[7].
Effet de groupe
Pour l’agrégation (effet de groupe), il a été montré que les proies non défensives privilégient rapidement une forme dispersée. Cela s’explique par le fait que les prédateurs avaient pour habitude de se concentrer sur ces agrégats de proies. Toutefois, dans le cas où les proies non défensives n’ont d’autre choix que de rester agrégées, les proies défensives se sont dispersées car elles sont défendues de façon fiable grâce à cette stratégie. Les résultats indiquent une fois de plus que les proies défendues auront tendance à faire évoluer des caractéristiques que les proies non défendues ne peuvent pas évoluer, et/ou rendraient les proies non défendues très vulnérables[7].
Stratégies développées par les prédateurs
On considère souvent qu’il existe entre les proies et les prédateurs des jeux comportementaux qui peuvent être sous-divisés en deux catégories distinctes. La première catégorie est composée des jeux liés à la rencontre : « un jeu dit pré-rencontre » qui va affecter directement le taux de rencontre entre un prédateur et sa proie, comme avec la sélection d’un habitat par les prédateurs. Il y a un second jeu dit « post-rencontre » qui affecte cette fois le résultat des rencontres, comprenant la mise à mort, la manipulation pour les prédateurs et l’évasion pour les proies. William A. Mitchell (2009) propose d’y associer un autre sous-jeu souvent traité indépendamment du premier, à savoir le jeu de vigilance des proies vis-à-vis des prédateurs[8].
L’étude des stratégies évolutivement stables (SES) permet d’observer la coévolution entre les prédateurs et les proies, appliquée ici plus particulièrement aux jeux comportementaux de la proie. Ainsi, il semble que les SES varient avec la capacité d’apprentissage des proies, notamment sur l’étude du mouvement des proies. Il faut prendre en compte que le déplacement des prédateurs comme des proies coûte de l’énergie, ainsi il semble que la meilleure réponse à la vigilance des proies est d’éviter des attaques rapides qui augmenteraient la probabilité d'échec de la capture, là où une attaque plus lente permettrait d’anticiper les mouvements aléatoires des proies et donc augmenter la probabilité de réussite de la capture. Lorsque les prédateurs possèdent une forte capacité de capture des proies, ces dernières évoluent en déduisant les mouvements ; les prédateurs se sont donc adaptés à la vigilance des proies en retardant leurs attaques (retards réduits en présence de prédateurs supplémentaires)[8].
Capacité d’apprentissage

Certaines proies ayant des mouvements aléatoires, la capacité de gestion des différents patchs par les prédateurs permet à ces derniers d’apprendre à s'adapter aux mouvements des proies dans un patch en particulier. L'apprentissage permettra aux prédateurs de dépenser moins d'énergie, mais cela permettra également d'augmenter la probabilité de capture. Il semble que les prédateurs réalisant un apprentissage ne sont pas forcément avantagés pour capturer des proies sédentaires, car ils sont moins adaptés que des prédateurs n’ayant pas augmenté leur capacité d’apprentissage et dépensant moins d’énergie pour capturer des proies sédentaires[8].
La densité de prédateurs
L’augmentation de la densité de prédateurs induit une augmentation du déplacement des proies, sans affecter leur vigilance. Cela rend la capture plus difficile pour les prédateurs ; de plus, la probabilité de rencontrer de nouveau une proie diminue. On peut également noter que le partage de la proie entre prédateurs diminue l’information concernant l’emplacement des proies, ce qui explique un faible partage des proies de la part de certains prédateurs[8].
Le taux de déplacement
Les prédateurs tentent d’apprendre l’emplacement des proies afin d’augmenter le taux de rencontre et donc potentiellement le taux de capture. Associé à la capacité d’apprentissage, lorsque les proies évoluent pour augmenter leur capacité d’évasion, le taux de déplacement des prédateurs va augmenter, permettant aux prédateurs de se déplacer dans un patch où les proies sont plus sédentaires. Une fois que les proies de ces nouveaux patchs auront à leur tour coévolué, les prédateurs retourneront au patch d’origine où beaucoup de proies seront redevenues sédentaires du fait de la migration des prédateurs. L’évolution du taux de déplacement permet également aux prédateurs d’estimer les patchs de qualité, plus propices à la sédentarisation des proies et à l'augmentation du taux de capture[8].
Ajout d'une espèce supplémentaire dans un système proie-prédateur
Insertion d'une seconde proie dans un système proie-prédateur
On considère souvent un système proie-prédateur composé d'une espèce de prédateur et d'une espèce de proie. Peter Abrams a étudié l'impact sur le système de l’ajout d'une autre espèce de proie afin de savoir s'il existait une coévolution.
Dans le cas d’une proie alternative, le prédateur devrait accroître sa capacité de capturer la proie 1 en réponse à cette proie améliorant ses capacités d’évasion[6].
Il n’y a pas de réponse coévolutive du prédateur à un changement de capacité d’évasion dans le système des proies simples. L’analyse implique donc que la présence d’une deuxième proie produit habituellement une réponse adaptative chez le prédateur qui contrecarre l’amélioration de la capacité d’évasion des proies 1, et qui ne se serait pas produite en l’absence de proie 2. De ce fait, lorsque la proie 1 améliore son adaptation d’évasion, le prédateur quant à lui améliore l’adaptation de la capture de la proie[6]. Ainsi, une deuxième proie réduit l’ampleur de la réaction coévolutive du prédateur aux changements de la première proie, car la première proie n’a pas besoin d’améliorer sa capacité d’évasion puisqu’il existe une deuxième proie.
Insertion d'un super prédateur dans un système proie-prédateur
Dans le cas de l’introduction d’un nouveau prédateur, de niveau supérieur, on a la création d’une chaîne trophique avec une proie, un prédateur moyen (initial) et un prédateur supérieur (ajouté) qui se nourrit d’individus des deux autres espèces. Dans ce cas, la supposition que seules les deux populations les plus faibles (proie et prédateur moyen) vont évoluer peut être faite. En effet, la présence du prédateur supérieur provoque une réaction coévolutive du prédateur moyen aux changements de sa proie ; aucune réponse ne se produirait en son absence. Pour la proie, le système reste le même que dans un système proie-prédateur classique notamment car le super prédateur diminue toujours la capacité d’évasion de la proie. En parallèle, la présence d’un super prédateur maintient les densités de prédateurs moyens à un niveau constant.
Avec l’ajout d’un super prédateur, les pressions de prédation exercées sur les proies changent et deviennent plus importantes que celles exercées dans un système proie-prédateur classique puisque les capacités de capture des prédateurs sont plus importantes. Par conséquent, la réaction adaptative de la proie sera augmentée en raison du prédateur supérieur[6].
Cas de l'herbivorie
L’herbivorie est aussi un cas de prédation puisque la plante est consommée, en partie ou en totalité, par un herbivore, considéré alors comme le prédateur.
Adaptation des végétaux
Les espèces végétales des forêts tropicales, et plus particulièrement des forêts tropicales sèches, souffrent davantage de l’herbivorie que celles des forêts tempérées. Les herbivores ont une préférence pour les jeunes feuilles en pleine croissance[9]. Ces espèces ont donc développé plusieurs systèmes de défense pour faire face aux attaques des prédateurs.
Tout d’abord, elles ont développé des systèmes de défenses physiques. En effet, les feuilles produites par certaines espèces sont plus dures pour rendre leur consommation plus difficile[9].

Ensuite, une grande variété de métabolites secondaires sont produites par les plantes et certains ont un rôle de défense chimique[9]. Par exemple, les terpènes retrouvés dans les résines sont répulsifs et toxiques[10]. Certaines de ces substances sont aussi photosensibilisatrices, c’est-à-dire qu’elles réagissent avec les cellules de la peau après exposition aux rayons lumineux et causent divers problèmes dermatologiques. C’est par exemple le cas de l’hypéricine chez les espèces du genre Hypericum, un photosensibilisateur chez les mammifères, ou des furocoumarines produites par des légumineuses. Ces dernières se lient aux molécules d’ADN des cellules de la peau et brisent les liaisons de ces molécules après exposition à des rayons UV[11] Les métabolites secondaires se retrouvent dans les latex et résines produits par les plantes. Ces exsudats sont aussi importants puisqu’en se solidifiant au contact de l’air ils peuvent piéger ou faire fuir des prédateurs[10]. Chez certaines espèces de la famille des Bursera, les résines produites contiennent des terpènes et sont éjectées avec force et en grande quantité hors des canaux en cas de blessure[10].
Finalement, les plantes peuvent aussi modifier leur phénologie, en modifiant l’apparition de certains évènements tels que la feuillaison ou la fructification. Ainsi, par exemple, certaines espèces des forêts tropicales ayant une saison sèche marquée peuvent produire des feuilles lorsque leurs prédateurs sont plus rares. Dans ce cas, le stress hydrique subi n’est pas limitant pour la production de feuilles, contrairement aux forêts tempérées, et l’abondance des prédateurs est significative, contrairement aux forêts avec des saisons sèches courtes ou peu marquées[9]. Une autre possibilité serait de produire une grande quantité de feuilles de façon synchrone puisque les herbivores causent plus de dommages sur les feuilles produites en dehors des pics de feuillaison[9].
Adaptation des prédateurs
Il existe de nombreuses espèces prédatrices de plantes, aussi bien chez les insectes telles que les chenilles de Lépidoptères ou de Coléoptères, que chez les mammifères herbivores, comme les ruminants.
Les insectes
Pour pouvoir faire face aux défenses développées par les plantes, les insectes se sont spécialisés à leur hôte et adaptent leurs réponses. Tout d’abord, ils peuvent adapter leurs comportements. Ainsi, une chenille de papillon consommant des plantes produisant des substances photosensibilisatrices va chercher à se protéger des rayons lumineux en roulant la feuille, de manière à se créer un abri ombragé[11]. Dans le cas des Blepharida (coléoptère spécialiste des plantes du genre Bursera), les chenilles ont appris à sectionner les nervures des feuilles pour éviter les jets de résines mortels[12]. Finalement, les insectes peuvent aussi métaboliser et excréter les composés chimiques consommés sans qu’ils ne les affectent[10].
La consommation de substances toxiques a aussi un avantage pour ces insectes : cela peut les rendre toxiques pour leurs propres prédateurs[10].
Les mammifères
Ces animaux ont développé des symbioses avec certaines bactéries du microbiote intestinal pour leur permettre de digérer par fermentation microbienne les plantes consommées. Cette association leur permet ainsi de détoxifier les métabolites secondaires et d’extraire les nutriments contenus dans leurs aliments[9]. Les mammifères ont aussi adapté leurs stratégies nutritives en étant plus généralistes et en consommant diverses parties des plantes (feuilles, graines, fruits)[9].
Articles connexes
Notes et références
- (en) Peter A Abrams, « THE EVOLUTION OF PREDATOR-PREY INTERACTIONS: Theory and Evidence », Annual Review of Ecology and Systematics ·, , p. 79-105 (lire en ligne)
- R. Dawkins et J. R. Krebs, « Arms Races between and within Species », Proceedings of the Royal Society of London. Series B, Biological Sciences, vol. 205, no 1161, , p. 489–511 (ISSN 0080-4649, lire en ligne, consulté le )
- Peter A. Abrams, « Adaptive Responses of Predators to Prey and Prey to Predators: The Failure of the Arms-Race Analogy », Evolution, vol. 40, no 6, , p. 1229 (ISSN 0014-3820, DOI 10.2307/2408950, lire en ligne, consulté le )
- (en) Edmund D. Brodie, B. J. Ridenhour et E. D. Brodie, « The Evolutionary Response of Predators to Dangerous Prey: Hotspots and Coldspots in the Geographic Mosaic of Coevolution Between Garter Snakes and Newts », Evolution, vol. 56, no 10, , p. 2067–2082 (ISSN 1558-5646, DOI 10.1111/j.0014-3820.2002.tb00132.x, lire en ligne, consulté le )
- The Coevolutionary Process (lire en ligne)
- (en) Peter A. Abrams, « The effects of interacting species on predator-prey coevolution », Theoretical Population Biology, vol. 39, no 3, , p. 241–262 (ISSN 0040-5809, DOI 10.1016/0040-5809(91)90022-8, lire en ligne, consulté le )
- (en) Thomas N. Sherratt et Christopher D. Beatty, « The Evolution of Warning Signals as Reliable Indicators of Prey Defense », The American Naturalist, vol. 162, no 4, , p. 377–389 (ISSN 0003-0147 et 1537-5323, DOI 10.1086/378047, lire en ligne, consulté le )
- (en) William A. Mitchell, « Multi-behavioral strategies in a predator–prey game: an evolutionary algorithm analysis », Oikos, vol. 118, no 7, , p. 1073–1083 (ISSN 1600-0706, DOI 10.1111/j.1600-0706.2009.17204.x, lire en ligne, consulté le )
- P. D. Coley et J. A. Barone, « Herbivory and plant defenses in tropical forests », Annual Review of Ecology and Systematics, vol. 27, no 1, , p. 305–335 (ISSN 0066-4162, DOI 10.1146/annurev.ecolsys.27.1.305, lire en ligne, consulté le )
- Judith X. Becerra, D. L. Venable, P. H. Evans et W. S. Bowers, « Interactions Between Chemical and Mechanical Defenses in the Plant GenusBurseraand Their Implications for Herbivores », American Zoologist, vol. 41, no 4, , p. 865–876 (ISSN 0003-1569, DOI 10.1093/icb/41.4.865, lire en ligne, consulté le )
- (en) M. Berenbaum, « Coumarins and Caterpillars: A Case for Coevolution », Evolution, vol. 37, no 1, , p. 163–179 (ISSN 1558-5646, DOI 10.1111/j.1558-5646.1983.tb05524.x, lire en ligne, consulté le )
- Judith X. Becerra et D. Lawrence Venable, « Rapid-Terpene-Bath and "Squirt-Gun" Defense in Bursera schlechtendalii and the Counterploy of Chrysomelid Beetles », Biotropica, vol. 22, no 3, , p. 320 (DOI 10.2307/2388545, lire en ligne, consulté le )