Chromate de plomb(II)
Le chromate de plomb, ou jaune de chrome, de formule PbCrO4, est une poudre cristalline utilisée comme pigment jaune (colorants pour matières plastiques, peinture, encre d'imprimerie et papeterie). Il s’obtient par réaction de l’acétate de plomb sur le bichromate de potassium. Le rouge de chrome, le jaune orangé de chrome et le jaune citron de chrome sont quelques-uns des pigments obtenus à partir du chromate de plomb.
| Chromate de plomb | |||
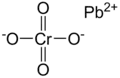
| |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Chromate de plomb | ||
| Synonymes |
jaune de chrome |
||
| No CAS | |||
| No ECHA | 100.028.951 | ||
| No CE | 231-846-0 | ||
| No RTECS | AJ9625000 | ||
| InChI | |||
| Apparence | poudre cristalline jaune à orange-jaune[1] | ||
| Propriétés chimiques | |||
| Formule | PbCrO4 | ||
| Masse molaire[2] | 323,2 ± 0,1 g/mol Cr 16,09 %, O 19,8 %, Pb 64,11 %, |
||
| pKa | 0,3 | ||
| Propriétés physiques | |||
| T° fusion | 844 °C[1] | ||
| Solubilité | dans l'eau à 25 °C : 0,000 058 g·L-1[1], soluble dans l'acide nitrique |
||
| Masse volumique | 6,3 g·cm-3[1] | ||
| Point d’éclair | 270 K | ||
| Pression de vapeur saturante | 141 hPa (20 °C) | ||
| Précautions | |||
| SGH[3] | |||
  Danger |
|||
| SIMDUT[4] | |||
 D2A, |
|||
| Transport | |||
|
|||
| Composés apparentés | |||
| Autres composés | |||
| Unités du SI et CNTP, sauf indication contraire. | |||
Comme il contient du plomb et du chrome, le chromate de plomb est toxique.
Sous l'action de la chaleur, on obtient une poudre rouge ou orange d'oxyde de plomb PbO et de trioxyde de chrome (CrO3).
En milieu basique, le chromate de plomb, après dissolution partielle, forme un complexe:
- PbCrO4 + 4 OH− → [Pb(OH)4]2− + CrO42−
Histoire
Portant son attention sur un cristal rouge brillant découvert en Sibérie au XVIIIe siècle, la crocoïte, décrite par J.-G. Lehrmann en 1762, le chimiste français Nicolas Louis Vauquelin y découvrit un nouveau métal dont les dérivés avaient tendance à être très colorés, que pour cette raison il appela « chrome ».
En synthétisant la crocoïte, d'un rouge brillant, Vauquelin découvrit un jaune très riche et en 1804, en collaboration avec Claude Louis Berthollet, il suggéra qu'il pourrait servir de pigment. Dès 1810, le jaune de chrome figurait dans la palette des artistes. Thomas Lawrence l'a utilisé cette année-là pour son Portrait d'un gentleman[5].
La tonalité exacte du jaune de chrome s'ajuste à la préparation. Plus on augmente la proportion de sulfate de plomb, plus la couleur est rougeâtre et foncée. La température et l'acidité modifient aussi la nuance.
Le jaune de chrome attirait la clientèle des artistes, mais restait cher, la matière première étant importée de Sibérie. En 1818, on commença l'exploitation de mines en France dans le Var, épuisées dès 1829 ; on en ouvrit aussi dans les îles Shetland et aux États-Unis, mais les jaunes de chrome restèrent chers. Dans les années suivantes, le marchand de couleurs parisien Pannetier développa un procédé pour fabriquer du vert de chrome, vendu en France sous le nom de vert émeraude et en Angleterre sous le nom de viridian, perfectionné par Guignet en 1859 (vert Guignet). Les composés de chrome débouchaient ainsi sur une variété de couleurs[6].
Peinture

Ce pigment industriel, PY34 du Colour Index, utilisé par les impressionnistes, noircit au cours du temps. Une étude sur des micro-échantillons de peinture de van Gogh analysés aux rayons X de l'ESRF de Grenoble révèle en 2011 le processus chimique : les rayons UV du soleil provoquent une réaction chimique de réduction du chrome (de Cr6+ à Cr3+) sur une profondeur de un à trois micromètres de la peinture, ce qui altère sa couleur.
Van Gogh mélangeait de la peinture blanche à son jaune pour le rendre plus lumineux. Son blanc était un sulfate de baryum dont les éléments chimiques baryum et soufre accélèrent cette réduction, d'où un brunissement plus rapide de sa peinture[7].
Usages routiers
Durant des décennies cette molécule a servi de pigment jaune pour le marquage routier et des bordures de trottoirs, dans la plupart des pays, avant d'être généralement remplacé par le blanc. En s'usant elle devenait l'un des contaminants de l'air urbain, avec les particules issues de l'usure des plaquettes de freins et de l'usure des pneus de véhicules[8].
Voir aussi
Bibliographie
- Philip Ball (trad. Jacques Bonnet), Histoire vivante des couleurs : 5000 ans de peinture racontée par les pigments [« Bright Earth: The Invention of Colour »], Paris, Hazan, , p. 229-232.
- Jean Petit, Jacques Roire et Henri Valot, Encyclopédie de la peinture : formuler, fabriquer, appliquer, t. 2, Puteaux, EREC, , p. 88.
Articles connexes
Liens externes
Références
- CHROMATE DE PLOMB, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Chromate de plomb » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- Ball 2010, p. 229.
- Ball 2010, p. 230-232.
- Tristan Vey, Pourquoi le jaune de Van Gogh perd de son éclat, Le Figaro, 14 février 2011 ; Ball 2010, p. 388.
- Adachi K & Tainosho Y (2004) Characterization of heavy metal particles embedded in tire dust. Environment international, 30(8), 1009-1017.