Chlorure de plomb(IV)
Le chlorure de plomb(IV) ou tétrachlorure de plomb ou tétrachloroplumbane ou chlorure plombique est un composé inorganique du plomb de valence IV et de chlore de formule PbCl4. Dans les conditions normales de température et de pression, c'est un liquide jaune huileux[1].
| Chlorure de plomb(IV) | |
| |
| Identification | |
|---|---|
| Nom UICPA | tétrachloroplumbane |
| No CAS | |
| No CE | 231-845-5 |
| PubChem | 123310 |
| SMILES | |
| InChI | |
| Apparence | liquide jaune huileux[1] |
| Propriétés chimiques | |
| Formule | PbCl 4 |
| Masse molaire[2] | 349 ± 0,1 g/mol Cl 40,63 %, Pb 59,37 %, |
| Propriétés physiques | |
| T° fusion | −15 °C[3] |
| Solubilité | réagit avec l'eau |
| Masse volumique | 3,2 g·cm-3[3] |
| Cristallographie | |
| Système cristallin | monoclinique |
| Classe cristalline ou groupe d’espace | (no 15) |
| Unités du SI et CNTP, sauf indication contraire. | |
Structure et propriétés
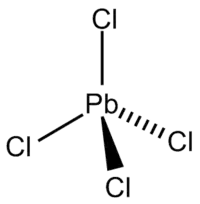
L'entité PbCl4 est moléculaire et présente une géométrie tétraédrique dans laquelle l'atome de plomb occupe la position centrale. La liaison covalente Pb-Cl est longue de 247 nm pour une énergie de liaison de 243 kJ·mol-1[4].

PbCl4 cristallise dans le système réticulaire monoclinique, groupe d'espace I2/a (no 15) avec comme paramètres de maille a = 1054,2 pm, b = 535,9 pm, c = 1195,8 pm et β = 115,83°, et avec un nombre d'unité par maille, Z = 4[5]
Réactivité
Le chlorure de plomb(IV) se décompose lorsqu'il est chauffé doucement pour former du chlorure de plomb(II) et du dichlore[1].
Il s'hydrolyse dans l'eau[1].
Synthèse
Le chlorure de plomb(IV) est obtenu par réaction entre l'acide sulfurique et [NH4]2[PbCl6], lui-même obtenu en faisant réagir du dichlore et du chlorure de plomb(II) dans le chlorure d'ammonium aqueux[1].
- PbCl2 + 2NH4Cl + Cl2 → [NH4]2[PbCl6]
- [NH4]2[PbCl6] + H2SO4 → PbCl4+ 2HCl + (NH4)2SO4
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Lead tetrachloride » (voir la liste des auteurs).
- Catherine Housecroft et Alan Sharpe (trad. de l'anglais par André Pousse), Chimie inorganique, Bruxelles/Paris, De Boeck, , 1097 p. (ISBN 978-2-8041-6218-4, lire en ligne), p. 408
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Lead: lead tetrachloride », sur webelements.com
- (en) John Emsley, The Elements, Oxford, Clarendon Press / Oxford University Press, , 292 p. (ISBN 0-19-855819-8), p. 114
- I. J. Maley, S. Parsons, C. R. Pulham, Lead(IV) chloride at 150 K, Acta Crystallographica, 2002, vol. 58, pp. i79–i81. DOI 10.1107/S1600536802015064.


