Camostat
Le Camostat est un inhibiteur de protéase à sérine. Ces dernières sont des enzymes qui ont des fonctions diverses dans l'organisme, de sorte que le camostat a diverses utilisations, notamment pour traiter certaines formes de cancer ou certains virus, ou pour prévenir les fibroses dans les maladies des reins, les hépatites ou les pancréatites[3] - [4] - [5] - [6] - [7]. Cette molécule (nom de développement FOY-305) a été commercialisée pour la première fois au Japon sous forme de comprimés à prise orale en 1985 par la firme pharmaceutique japonaise ONO sous le nom de FOIPAN. Ce médicament (camostat mésilate, comprimé à 100 mg) est actuellement fabriqué et vendu au Japon et en Corée du Sud sous plusieurs noms commerciaux. Il possède de nombreux génériques. Ses principales indications sont les pancréatites chroniques (600 mg/j) et les reflux œsophagiens post-opératoires (300 mg/j). Mi-mars 2020, le médicament est vendu environ 60 euros les 50 comprimés pour la marque princeps et environ 31 euros les 100 comprimés pour certains génériques.
| Camostat | |||
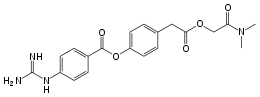
| |||
| Structure du Camostat | |||
| Identification | |||
|---|---|---|---|
| Nom systématique | 4-(diaminométhylidèneamino)benzoate de 4-[2-[2-(diméthylamino)-2-oxoéthoxy]-2-oxoéthyl]phényle | ||
| Synonymes |
mésylate de camostat |
||
| No CAS | |||
| Code ATC | B02 | ||
| PubChem | 2536 | ||
| ChEBI | 135632 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C20H22N4O5 |
||
| Masse molaire[1] | 398,412 5 ± 0,019 8 g/mol C 60,29 %, H 5,57 %, N 14,06 %, O 20,08 %, |
||
| Précautions | |||
| SGH[2] | |||
  Attention |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Il a été observé in vitro qu'il réduirait significativement l'infection de cellules Calu-3 par le SARS-CoV-2[8].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Camostat mesylate ≥98% (HPLC), consultée le 13 mars 2020.
- (en) Masataka Okuno, Soichi Kojima, Kuniharu Akita, Rie Matsushima-Nishiwaki, Seiji Adachi, Tetsuro Sano, Yukihiko Takano, Koji Takai, Akihiro Obora, Ichiro Yasuda, Yoshimune Shiratori, Yukio Okano, Jun Shimada, Yasuhiro Suzuki, Yasutoshi Muto et Hisataka Moriwaki, « Retinoids in Liver Fibrosis and Cancer », Frontiers in Biosciences, vol. 7, , d204-d218 (PMID 11779708, DOI 10.2741/A775, lire en ligne)
- (en) Hsing-Pang Hsieh et John T.-A. Hsu., « Strategies of Development of Antiviral Agents Directed Against Influenza Virus Replication », Current Pharmaceutical Design, vol. 13, no 34, , p. 3531-3542 (PMID 18220789, DOI 10.2174/138161207782794248, lire en ligne)
- (en) Kenichiro Kitamura et Kimio Tomita, « Proteolytic activation of the epithelial sodium channel and therapeutic application of a serine protease inhibitor for the treatment of salt-sensitive hypertension », Clinical and Experimental Nephrology, vol. 16, no 1, , p. 44-48 (PMID 22038264, DOI 10.1007/s10157-011-0506-1, lire en ligne)
- (en) Miki Ueda, Kohei Uchimura, Yuki Narita, Yoshikazu Miyasato, Teruhiko Mizumoto, Jun Morinaga, Manabu Hayata, Yutaka Kakizoe, Masataka Adachi, Taku Miyoshi, Naoki Shiraishi, Daisuke Kadowaki, Yoshiki Sakai, Masashi Mukoyama et Kenichiro Kitamura, « The Serine Protease Inhibitor Camostat Mesilate Attenuates the Progression of Chronic Kidney Disease Through Its Antioxidant Effects », Nephron, vol. 129, no 3, , p. 223-232 (PMID 25766432, DOI 10.1159/000375308, lire en ligne)
- (en) Markus Hoffmann, Hannah Kleine-Weber, Simon Schroeder, Nadine Krüger, Tanja Herrler, Sandra Erichsen, Tobias S. Schiergens, Georg Herrler, Nai-Huei Wu, Andreas Nitsche, Marcel A. Müller, Christian Drosten, Stefan Pöhlmann, Show less et Show footnotes, « SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor », Cell, vol. 181, , p. 1-10 (PMID 32142651, DOI 10.1016/j.cell.2020.02.052, lire en ligne)