Bromure de cuivre(II)
Le bromure de cuivre(II) (CuBr2) est un composé chimique. Il est utilisé pour le traitement des images photographiques et comme agent de bromation en synthèse organique[2].
| Bromure de cuivre(II) | |
| |
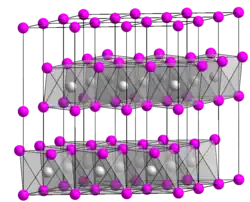
| Structure cristalline du bromure de cuivre(II) (atomes de cuivre en gris, atomes de brome en rose). | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.029.243 |
| PubChem | 24611 |
| Apparence | cristal hygroscopique noir grisâtre |
| Propriétés chimiques | |
| Formule | CuBr2 |
| Masse molaire[1] | 223,354 ± 0,005 g/mol Br 71,55 %, Cu 28,45 %, |
| Propriétés physiques | |
| T° fusion | 498 °C |
| T° ébullition | 900 °C à 100 kPa |
| Solubilité | 55,7 g/100 mL dans l'eau à 20 °C |
| Masse volumique | 4,710 g/cm3 |
| Unités du SI et CNTP, sauf indication contraire. | |
Il est aussi utilisé pour les lasers à vapeur de cuivre, une classe de laser où le milieu amplificateur est de la vapeur de bromure de cuivre formé in situ à partir de bromure d'hydrogène qui réagit avec le tube de décharge en cuivre[3]. Il produit une lumière jaune ou verte, il est utilisé pour des applications en dermatologie.
Synthèse
Le bromure de cuivre(II) est obtenu en associant l'oxyde de cuivre(II) et l'acide bromhydrique[4] :
- CuO + 2HBr → CuBr2 + H2O.
Purification
Le bromure de cuivre(II) est purifié par cristallisation deux fois dans l'eau, filtré pour enlever le CuBr et concentré sous vide. Ce produit est ensuite déshydraté avec du pentoxyde de phosphore[5].
Structure
À l'état solide, CuBr2 a une structure polymérique, avec CuBr4 les unités planes des côtés opposés se connectent pour former une chaîne.
La structure cristalline est monoclinique, groupe d'espace C2/m, avec comme paramètres cristallins a = 714 pm, b = 346 pm, c = 718 pm et ß = 121° 15'[6]. L'unité monomère CuBr2 est présente dans la phase gazeuse à haute température[7]. Il crée des solutions vert-bleu vif dans l'eau et réagit exothermiquement avec l'aluminium :
- 3 CuBr2 + 2 Al → 2 AlBr3 + 3 Cu.
Réactions
Le bromure de cuivre(II) dans l'acétate d'éthyle-chloroforme réagit avec la cétone et forme des α-bromocétones. Le produit de ce résultat peut être directement utilisé pour la préparation de dérivés. Cette méthode hétérogène est connue pour être la méthode la plus sélective et directe pour former des α-bromocétones[8].
La dibromination des néopentylglycols, en utilisant la combinaison des réactifs CuBr2/LiBr est réalisée pour que le néopentylglycol serve d'accepteur de glycosyle pour le couplage des ions halonium. Ces réactions donnent des rendements élevés de dibromides pour les sucres alcényles qui sont résistants à une réaction directe avec une molécule de brome[9].
Usages
Les lasers au bromure de cuivre(II) produisent des impulsions de lumière jaune et verte et sont étudiés pour un possible traitement des lésions cutanées[10]. Des expériences ont montré que le traitement au bromure de cuivre(II) est bénéfique pour le rajeunissement de la peau[11].
Il a été largement utilisé en photographie. La solution était utilisée comme étape de blanchissement pour intensifier des négatifs au collodion et à la gélatine[12].
Le bromure de cuivre(II) a aussi été proposé comme possible matériau pour les capteurs d'humidité[13].
Sécurité
Le bromure de cuivre(II) est nocif en cas d'ingestion. Il affecte le système nerveux central, le cerveau, les yeux, le foie et les reins. Il est irritant pour la peau, les yeux et les voies respiratoires.
Présence dans la nature
Le bromure de cuivre(II) pur est en 2020 inconnu parmi les minéraux. Cependant, la barlowite, Cu4BrF(OH)6, est digne d'être mentionnée[14] - [15].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Copper(II) bromide » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Jianhui Huang, Simon J. F. Macdonald et Joseph P. A. Harrity, « A cycloaddition route to novel triazole boronic esters », Chem. Commun., no 4, , p. 436–438 (PMID 19137177, DOI 10.1039/b817052e).
- E. S. Livingstone et A. Maitland, « A high power, segmented metal, copper bromide laser », Measurement Science and Technology, vol. 2, no 11, , p. 1119 (ISSN 0957-0233, DOI 10.1088/0957-0233/2/11/022, Bibcode 1991MeScT...2.1119L).
- Synthetic methods of Organometallic and Inorganic Chemistry, New York, Thieme Medical Publishers, (ISBN 0-86577-662-8).
- Hope et al., J. Chem. Soc., 5226, 1960, Glemser & Sauer, dans Handbook of Preparative Inorganic Chemistry, Éd. Brauer, Academic Press, vol. II, p. 1009, 1965.
- Lindsay Helmholz, « The Crystal Structure of Anhydrous Cupric Bromide », J. Am. Chem. Soc., vol. 69, no 4, , p. 886–889 (DOI 10.1021/ja01196a046).
- Rebecca R. Conry, « Encyclopedia of Inorganic Chemistry », dans Rebecca R. Conry, Encyclopedia of Inorganic Chemistry, , 2e éd. (ISBN 978-0-470-86210-0, DOI 10.1002/0470862106.ia052).
- L. Carroll King et G. Kenneth Ostrum, « Selective Bromination with Copper(II) Bromide », J. Org. Chem., vol. 29, no 12, , p. 3459–3461 (DOI 10.1021/jo01035a003).
- Robert Rodebaugh, John S. Debenham, Burt J. Fraser-Reid et James P. Snyder, « Bromination of Alkenyl Glycosides with Copper(II) Bromide and Lithium Bromide: Synthesis, Mechanism, and DFT Calculations », J. Org. Chem., vol. 64, no 5, , p. 1758–1761 (PMID 11674253, DOI 10.1021/jo9718509).
- S. McCoy, M. Hanna, P. Anderson, G. McLennan et M. Repacholi, « An evaluation of the copper-bromide laser for treating telangiectasia », Dermatol. Surg., vol. 22, no 6, , p. 551–7 (ISSN 1076-0512, PMID 8646471, DOI 10.1111/j.1524-4725.1996.tb00373.x, S2CID 22626280).
- Davis P., Town G. et Haywards H., A practical comparison of IPLs and the Copper Bromide Laser for photorejuvenation, acne and the treatment of vascularπgmented lesions.
- Diane Heppner, The Focal Encyclopedia of Photography, Elsevier, 2007, 4e éd.
- George McKedy, US Patent Application Publication, Pub.No.: US2010/0252779 A1.
- « Verification ».
- « List of Minerals », .