Benzamidine
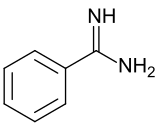
La benzamidine est le composé organique de formule C6H5C(NH)NH2. C'est l'aryle amidine le plus simple. Le composé est un solide blanc légèrement soluble dans l'eau. Il est généralement manipulé sous forme de sel chlorhydrate[2].
| Benzamidine | |
| |
| Identification | |
|---|---|
| Nom UICPA | benzenecarboximidamide |
| No CAS | |
| No ECHA | 100.009.589 |
| PubChem | |
| ChEBI | 41033 |
| SMILES | |
| InChI | |
| Apparence | solide blanc |
| Propriétés chimiques | |
| Formule | C7H8N2 [Isomères] |
| Masse molaire[1] | 120,151 8 ± 0,006 6 g/mol C 69,97 %, H 6,71 %, N 23,32 %, |
| Propriétés physiques | |
| T° fusion | 78–80 °C |
| Solubilité | > 18 µg/mL |
| Masse volumique | 1,22 g·cm−3 |
| Précautions | |
| SGH | |
 Attention |
|
| Unités du SI et CNTP, sauf indication contraire. | |
En termes de structure moléculaire, la benzamidine présente une liaison courte C=NH et une liaison C-NH2 plus longue, respectivement 129 et 135 picomètres[3].
Applications
La benzamidine est un inhibiteur compétitif réversible de la trypsine, des enzymes de type trypsine et des sérine protéases[4]. Historiquement, elle a été utilisée dans la préparation de protéoglycane riche en sulfate d'héparane à partir de cellules épithéliales mammaires de souris. Elle a permis en outre d'empêcher la dégradation enzymatique pendant la procédure de purification du facteur XII bovin (facteur Hageman).
Le composé est souvent utilisé comme ligand dans la cristallographie des protéines pour protéger les protéines des protéases. Une structure partielle de benzamidine peut être trouvée dans certains produits pharmaceutiques, comme le dabigatran.
Les imidazoles dérivés sont formés par condensation avec des α-halocétones.
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Bryan Li, Charles K-F Chiu, Richard F. Hank, Jerry Murry, Joshua Roth, Harry Tobiassen, « Preparation of 2,4-Disubstituted Imidazoles: 4-(4-Methoxyphenyl)-2-Phenyl-1H-Imidazole », Organic Syntheses, vol. 81, , p. 105 (DOI 10.15227/orgsyn.081.0105)
- Barker, Phillips, Wallbridge et Powell, « Benzamidine », Acta Crystallographica Section C Crystal Structure Communications, vol. 52, no 10, , p. 2617–2619 (DOI 10.1107/S0108270196006282)
- Tanizawa, Ishii, Hamaguchi et Kanaoka, « Proteolytic EnzymesVI. Aromatic Amidines as Competitive Inhibitors of Trypsin », The Journal of Biochemistry, vol. 69, no 5, , p. 893–899 (ISSN 0021-924X, PMID 5577153, DOI 10.1093/oxfordjournals.jbchem.a129540, lire en ligne)