Arséniate de potassium
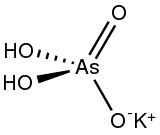
L'arséniate de potassium ou plus exactement le dihydrogénoarséniate de potassium ou encore l'arséniate de potassium monobasique est le composé chimique de formule KH2AsO4. D'autres sels sont également appelés arséniate de potassium, K2HAsO4 (hydrogénoarséniate de potassium) et K3AsO4 (arséniate de potassium "vrai"). Chacune de ces espèces est dérivée de l'acide arsénique :
| Arséniate de potassium | |
| |
| Identification | |
|---|---|
| Nom UICPA | Dihydrogénoarséniate de potassium |
| No CAS | [1] |
| No ECHA | 100.029.150 |
| No CE | 232-065-8 |
| No RTECS | CG1100000 |
| PubChem | 516881 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | H2AsKO4 |
| Masse molaire[2] | 180,033 4 ± 0,001 5 g/mol H 1,12 %, As 41,62 %, K 21,72 %, O 35,55 %, |
| Précautions | |
| Directive 67/548/EEC | |
 T  N |
|
| Inhalation | Toux. Maux de tête. Respiration difficile. Mal de gorge. Faiblesse. |
| Peau | Rougeur. Douleur. |
| Yeux | Rougeur. Douleur. |
| Ingestion | Douleurs abdominales. Sensation de brûlure derrière le sternum et dans la bouche. Diarrhée. Vertiges. Maux de tête. Choc ou collapsus. Vomissements. |
| Unités du SI et CNTP, sauf indication contraire. | |
Ces espèces sont étroitement liées aux phosphates de potassium correspondants. Les anions H2AsO4−, HAsO42− et AsO43− contiennent tous la forme tétraédrique AsO4 avec deux, un, ou pas d'atomes d'hydrogène liés à l'atome d'oxygène, respectivement.
Bien que ces sels d'arsenic aient été prescrits à des fins thérapeutiques, ces composés sont hautement toxiques.
Ecotoxycologie
L'arséniate de potassium est un polluant marin.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Sodium arsenate » (voir la liste des auteurs).
- https://www.cdc.gov/niosh/ipcsnfrn/nfrn1210.html
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.


