Anthocyanidine
Les anthocyanidines ou anthocyanidols sont une sous-classe des flavonoïdes au sens large. Ce sont des pigments naturels, basés sur la structure de l'ion flavylium (ion 2-phénylchroménylium). Leurs dérivés hétérosides sont appelés anthocyanes, anthocyanosides ou encore anthocyanines[N 1].
Les anthocyanidols forment un grand groupe de colorants polyméthines.
Le contre-anion du flavylium est la plupart du temps l'ion chlorure. De par cette charge positive, les anthocyanidols diffèrent des autres flavonoïdes.
Structure des anthocyanidols
La structure de base des anthocyanidols (anthocyanidines) est formée de deux noyaux aromatiques A et B joints par 3 carbones formant avec l'oxygène le cycle C. La classification des flavonoïdes étant basée sur le degré d'oxydation de ce cycle C, les anthocyanidols se définissent simplement par les deux doubles liaisons du cycle C qui par conséquent porte une charge positive.
Les anthocyanidols existent en milieu acide sous la forme cationique. Les plus communs sont hydroxylés en C3 et penta- ou hexasubstitués par des hydroxyles et/ou des méthoxyles[2]. À eux seuls, les anthocyanidols hydroxylés en C-3, 5, 7 représentent environ 90 % des anthocyanidols connus en 2006[3]. Les six principaux sont : le cyanidol (cyanidine) qui donne un pigment cramoisi, le pélargonidol (pélargonidine) un pigment écarlate, le delphinidol pourpre-violet, le malvidol violet, le péonidol rouge et le pétunidol violet.
Les 3-désoxyanthocyanidols (sans groupe hydroxyle -OH sur le carbone C-3) sont plus rares et relativement stables.
En 2009, Davies[3] recense 31 anthocyanidols naturels.
| Structures des anthocyanidols , d'après Davies[3] (2009) et Sarni-Manchado et als[1] (2006) | ||||||||||
| Nom | Structure | R3' | R4' | R5' | R3 | R5 | R6 | R7 | CAS | Couleur à pH<1 |
|---|---|---|---|---|---|---|---|---|---|---|
| Les 6 anthocyanidols les plus fréquents | 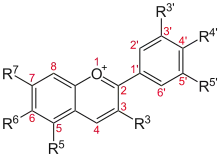 | |||||||||
| Cyanidine | −OH | −OH | −H | −OH | −OH | −H | −OH | Orange-rouge | ||
| Delphinidine | −OH | −OH | −OH | −OH | −OH | −H | −OH | Violet | ||
| Pélargonidine | −H | −OH | −H | −OH | −OH | −H | −OH | Orange | ||
| Malvidine | −OCH3 | −OH | −OCH3 | −OH | −OH | −H | −OH | Violet | ||
| Péonidine | −OCH3 | −OH | −H | −OH | −OH | −H | −OH | Rouge | ||
| Pétunidine | −OCH3 | −OH | −OH | −OH | −OH | −H | −OH | Violet | ||
| 3-Deoxyanthocyanidines | ||||||||||
| Apigéninidine | −H | −OH | −H | −H | −OH | −H | −OH | Orange | ||
| Lutéolinidine | −OH | −OH | −H | −H | −OH | −H | −OH | Orange | ||
| Tricétinidine | −OH | −OH | −OH | −H | −OH | −H | −OH | Rouge | ||
| 6-Hydroxyanthocyanidols | ||||||||||
| 6-Hydroxypélargonidine ou Aurantinidine | −H | −OH | −H | −OH | −OH | −OH | −OH | Orange | ||
| 6-Hydroxycyanidine | −OH | −OH | −H | −OH | −OH | −OH | −OH | Rouge | ||
| 6-Hydroxydelphinidine | −OH | −OH | −OH | −OH | −OH | −OH | −OH | Rouge | ||
| Anthocyanidols méthylés rares | ||||||||||
| Europinidine | −OCH3 | −OH | −OH | −OH | −OCH3 | −H | −OH | Violet | ||
| Rosinidine | −OCH3 | −OH | −H | −OH | −OH | −H | −OCH3 | Rouge | ||
| Capensinidine | −OCH3 | −OH | −OCH3 | −OH | −OCH3 | −H | −OH | Violet | ||
| Pulchéllidine | −OH | −OH | −OH | −OH | −OCH3 | −H | −OH | Violet | ||
| Hirsutidine | −OCH3 | −OH | −OCH3 | −OH | −OH | −H | −OCH3 | Violet | ||
| 5-Méthylcyanidine | −OH | −OH | −H | −OH | −OCH3 | −H | −OH | Orange-rouge | ||
| Anthocyanidols rares | ||||||||||
| Fisétinidine | −H | −OH | −OH | −OH | −H | −H | −OH | |||
Les 6 anthoxyanidols les plus fréquents sont classés parmi les additifs alimentaires :
| Anthocyanidols additifs alimentaires | ||||||
| Anthocyanidol | Cyanidine | Delphinidine | Pélargonidine | Malvidine | Péonidine | Pétunidine |
| Numéro E | E163a | E163b | E163d | E163c | E163e | E163f |
Le noyau flavylium des anthocyanidols manifestant une forte réactivité avec les nucléophiles, il en résulte une grande instabilité de ces métabolites dans les tissus végétaux[1]. Leur stabilisation se fait par une glycosylation.
Couleurs des anthocyanidols
La couleur des anthocyanidols provient des doubles liaisons conjuguées du cation flavylium responsable de l'absorption de la lumière dans les environs de 500 nm (vert) et donnant une impression de rouge à l’œil humain[N 2]. Suivant le degré d'hydroxylation et de méthoxylation, la teinte dominante des anthocyanidols varie de l'orange au violet[1]. Ainsi on passe du pélargonidol de couleur orange au delphinidol violet, par une augmentation du nombre d'hydroxyles -OH sur le cycle B (en position 3' et 5') entrainant un déplacement de l'absorbance maximale dans le visible vers les grandes longueurs d'onde.
En revanche, si les hydroxyles (en 3' ou 5') sont remplacés par des méthoxyles -OCH3, le chromophore est beaucoup plus rouge et stable. Ainsi, des extraits aqueux contenant principalement du pélargonidol ou du cyanidol glycolysés apparaissent rouge-orangé, alors que ceux contenant du péonidol glycolysé sont rouge foncé, et ceux contenant des glycosides de delphinidol, pétunidol, malvidol ont une coloration violette (rouge bleuté).
Hétérosides
Comme la plupart des flavonoïdes, les anthocyanidols sont présents dans la nature sous forme d'hétérosides, dans lesquels ils jouent le rôle de l'aglycone. Ces hétérosides, appelés des anthocyanosides ou anthocyanes, forment des molécules beaucoup plus stables que les aglycones seuls.
Les anthocyanosides s'accumulent dans les vacuoles des cellules épidermiques. Ils sont présents dans les pétales de fleurs comme les pavots ou les mauves mais c'est dans les fruits qu'ils sont à plus forte concentration : sureau (0,2-1,8 %), jus de grenade (0,6-0,7 %) ou raisin noir (0,03-0,7 %).
Test de Bate-Smith

Le test de Bate-Smith est une méthode de quantification totale des tanins condensés (proanthocyanidines) par dépolymérisation par hydrolyse acide. Deux tubes sont préparés. Un est porté à 100°C pendant 30 minutes et à l'autre est gardé à 0°C durant le même temps (tube témoin). En présence de tanins condensés, une coloration rouge se développe. On stoppe la réaction avec un ajout d'éthanol. On mesure la différence d'absorbance à 550 nm entre les deux tubes. Cette différence est en rapport avec la quantité d'anthocyanidines formées, qui est elle-même en rapport avec la concentration initiale en tanin[4].
Notes
- Jean Bruneton préfère maintenir le suffixe -oside pour les hétérosides et le suffixe -ol pour les polyphénols. Pour éviter les risques de confusion entre anthocyanidines et anthocyanines, on préfèrera anthocyanidols et anthocyanosides
- la lumière perçue a été réfléchie et donc non absorbée
Références
- P. Sarni-Manchado, V. Cheynier, Les polyphénols en agroalimentaire, Lavoisier, Editions Tec & Doc, , 398 p. (ISBN 2-7430-0805-9)
- Bruneton, J., Pharmacognosie - Phytochimie, plantes médicinales, 4e éd., revue et augmentée, Paris, Tec & Doc - Éditions médicales internationales, , 1288 p. (ISBN 978-2-7430-1188-8)
- Kevin M. Davies, « Modifying Anthocyanin Production in Flowers », in K. Gould, K. Davies, C. Winefield, ANTHOCYANINS Biosynthesis, Functions, and Applications, Springer,
- (en) Adeline Vignault, Maria Reyes González-Centeno, Olga Pascual, Jordi Gombau, Michael Jourdes, Virgini eMoine, Nerea Iturmendi, Juan Miquel Canals, Fernando Zamora & Pierre-Louis Teissedre, 2018. Chemical characterization, antioxidant properties and oxygen consumption rate of 36 commercial oenological tannins in a model wine solution. Food Chemistry, Volume 268, 1 December 2018, Pages 210-219, DOI 10.1016/j.foodchem.2018.06.031.