Acide thiophosphorique
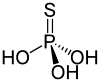
L'acide thiophosphorique est un composé chimique de formule H3PO3S. Il se présente comme un liquide clair qui peut être conservé à l'abri de l'air sous forme d'acide concentré jusqu'à 83 % à une température inférieure à 2 °C ; il gèle en dessous de −60 °C. Au contact de l'air, il se forme un dépôt de soufre résultant de l'oxydation du sulfure d'hydrogène H2S résultant de l'hydrolyse progressive du composé. Le sulfure d'hydrogène se forme abondamment si l'on chauffe l'acide concentré au-delà de 40 °C. Sa structure n'est pas déterminée formellement, mais deux tautomères sont plausibles : (HO)3PO=S et (HO)2HSP=O.
| Acide thiophosphorique | |
| |
| Structure de l'acide thiophosphorique | |
| Identification | |
|---|---|
| Nom UICPA | acide O,O,S-phosphorothioïque |
| Synonymes |
acide monothiophosphorique |
| No CAS | |
| PubChem | 167254 |
| ChEBI | 46613 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | H3PO3S |
| Masse molaire[1] | 114,061 ± 0,006 g/mol H 2,65 %, O 42,08 %, P 27,16 %, S 28,11 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
On peut obtenir l'acide thiophosphorique à l'issue d'un processus en plusieurs étapes commençant par l'hydrolyse basique du pentasulfure de phosphore P2S5 pour donner un dithiophosphate PO2S2− isolé sous forme d'un sel de baryum[2] :
Dans une séconde étape, le sel de baryum est décomposé avec de l'acide sulfurique H2SO4, ce qui donne un précipité de sulfate de baryum BaSO4 et libère l'acide dithiophosphorique H3PO2S2 :
Sous des conditions contrôlées, l'acide dithiophosphorique s'hydrolyse pour donner l'acide monothiophosphorique :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) R. Klement, « Phosphorus », dans Handbook of Preparative Inorganic Chemistry, vol. 1, p. 568,570, G. Brauer, Academic Press, 2e édition, 1963, New York.