Échinomycine
L'échinomycine ou lévomycine[2] ou quinomycine A[2] est un antibiotique polypeptidique cytotoxique contenant deux substituants quinoxaline qui se lie à l'ADN et inhibe la synthèse des ARN[2]. Il s'intercale dans l'ADN sur deux sites spécifiques, bloquant ainsi la fixation du facteur HIF1alpha (hypoxia inducible factor 1 alpha).
| Échinomycine | |

| |
| Identification | |
|---|---|
| Nom UICPA | N-[2,4,12,15,17,25-hexaméthyl-29-méthylsulfanyl-3,6,10,13,16,19,23,26-octaoxo-11,24-di(propan-2-yl)-7-(quinoxaline-2-carbonylamino)-9,22-dioxa-28-thia-2,5,12,15,18,25-hexazabicyclo[12.12.3]nonacosan-20-yl]quinoxaline-2-carboxamide |
| Synonymes |
quinomycine A, lévomycine |
| No CAS | , (lévomycine) |
| No ECHA | 100.164.832 |
| PubChem | 3197 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C51H64N12O12S2 [Isomères] |
| Masse molaire[1] | 1 101,257 ± 0,061 g/mol C 55,62 %, H 5,86 %, N 15,26 %, O 17,43 %, S 5,82 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Biosynthèse
L'échinomycine est synthétisée par une unique peptide-synthétase non ribosomique (PNRs)[3]. L'échinomycine peut être isolée de diverses bactéries telles que Streptomyces lasalienis ou Streptomyces echinatus. Elle appartient à la famille d'antibiotiques quinoxaline qui sont très intéressants parce qu'ils ont de fortes propriétés antibactériennes, anticancéreuses et même une activité antivirale[4].
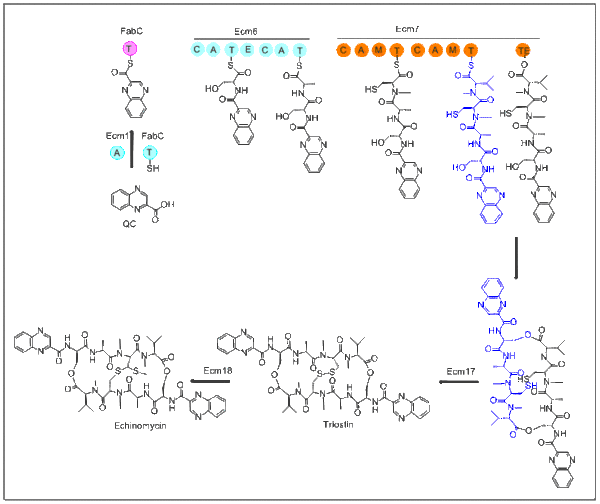
La biosynthèse de l'échinomycine commence par la molécule QC (ci-dessous). Le L-tryptophane est le précurseur de la biosynthèse de QC et cette étape est identique à la première étape de la biosynthèse de la nikkomycine. Après que QC est synthétisé, le domaine d'adénylation contenant Ecm1 active et transfère QC à FabC en utilisant une protéine porteuse d'acyle (ACP) de biosynthèse d'acides gras. Le premier module suivant Ecm6 accepte QC-SFabC en tant que l'unité de démarrage. Emc7 contient un domaine terminal thioestérase qui permet au peptide de dimériser et d'être relâché. Ce produit cyclique va ensuite à Ecm17, une oxydoréductase, qui crée un pont disulfure. La dernière étape de cette biosynthèse transforme la liaison disulfure dans un pont thioacétal. Cette transformation a lieu avec Ecm18, qui est assez similaire à la méthyltransférase dépendante de la S-adénosyl-L-méthionine (en)(SAM)[4].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Echinomycin » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- PubChem CID : 3197
- K. Watanabe, H. Oguri, H. Oikawa, Diversification of echinomycin molecular structure by way of chemoenzymatic synthesis and heterologous expression of the engineered echinomycin biosynthetic pathway, Current Opinion in Chemical Biology, 2009, vol. 13(2), pp. 189–196. DOI 10.1016/j.cbpa.2009.02.012, .
- K. Watanabeet al., Total biosynthesis of antitumor nonribosomal peptides in Escherichia coli, Nature chemical biology, 2006, vol. 2(8), pp. 423–428. DOI 10.1038/nchembio803, .