Triiodure d'azote
Le triiodure d'azote, également appelé iodure d'azote, est un composé chimique de formule NI3. C'est l'un des explosifs les plus sensibles qui soient, l'explosion pouvant être déclenchée par une pression infime, un simple courant d'air, voire des particules subatomiques produites par fission nucléaire[2]. Cette propriété lui retire tout intérêt pratique puisqu'il ne peut être ni transporté ni stocké dans des conditions suffisamment sûres (contrairement à la nitroglycérine, qui peut être stabilisée sous forme de dynamite), ce qui rend par ailleurs problématique l'étude de ses propriétés physicochimiques.
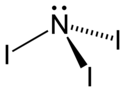
Structure
Le triiodure d'azote, comme les autres halogénures d'azote NF3, NCl3 et NBr3, a une structure pyramidale, comme l'ammoniac dont il dérive. Sa structure a été établie en 1990[3]. Il a pu être isolé en tant que NI3 (et pas seulement comme adduit NI3•NH3) à la suite de la réaction, à −30 °C du nitrure de bore BN avec le monofluorure d'iode IF.
- BN + 3IF → BF3 + NI3
Sa purification a mis en œuvre une sublimation à basse température. Son spectre raman est conforme à une molécule de symétrie C3v.
Préparation
Le triiodure d'azote se prépare le plus facilement sous forme d'adduit avec l'ammoniac suivant l'équation :
- 5NH3 + 3I2 → NI3•NH3 + 3NH4+ + 3I−
Du diiode finement broyé est introduit dans une solution concentrée d'ammoniac à température ambiante. Après quelques minutes d'agitation à température ambiante, le mélange est filtré sur papier filtre.
La situation devient alors dangereuse puisque le produit est susceptible de s'assécher, donc de devenir explosif. Il doit être détruit en petite quantité (largement inférieure au gramme) après avoir été abandonné à l'air libre et touché avec une longue baguette, une fois sec, pour le faire exploser. La violente détonation libère du diiode, ce qui n'est pas non plus sans conséquence sur la santé.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Bowden, F. P. Initiation of explosion by neutrons, α-particles, and fission products. Proc. Roy. Soc. (London) 1958, A246, 216-19.
- Tornieporth-Oetting, I.; Klapötke, T. (1990). Nitrogen Triiodide. Angewandte Chemie International, 29e édition, p677–679.