Thiosulfinate
En chimie des composés organosulfurés, un thiosulfinate est un groupe fonctionnel consistant en un lien R-S(=O)-S-R (R étant un radical organique).
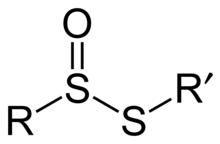
Les thiosulfinates sont parfois appelés aussi ester d'acide alcanethiosulfinique (ou arenèthiosulfinique. Ce sont les premiers membres de la famille des composés comportant une liaison disulfure oxydée. D'autres membres de cette famille sont les thiosulfonates, R-SO2-S-R, les α-disulfoxydes, R-S(O)-S(O)-R, les sulfones de sulfinyle, R-S(O)-SO2-R, et les α-disulfones, R-SO2-SO2-R. Le groupe thiosulfinate peut être présent dans les molécules acycliques comme dans les molécules cycliques[1] - [2] - [3].
Occurrence
On trouve de nombreux thiosulfinates acycliques ou cycliques dans les plantes, ou se formant lorsque les plantes sont coupées ou écrasées. On peut citer parmi les plus connus l'allicine, CH2=CHCH2S(O)SCH2CH=CH2, un des composés actifs se formant lorsque l'ail est écrasé. Elle a été découverte en 1944 par Chester John Cavallito et ses collègues. Différents mélanges de thiosulfinates contenant des groupes de méthyle, n-propyle, 1-propényle, 2-propényle, n-butyle, 1-butényle et 2-butényle sont formés lorsqu'on écrase différents types d'Allium et de Brassica[4] - [5]. Écraser les racines de Petiveria alliacea permet d'obtenir les thiosulfinates 2-hydroxyéthanethiosulfinate de S-2-hydroxyéthyle, phénylméthanethiosulfinate de S-2-hydroxyléthyle , 2-hydroxyéthanethiosulfinate de S-benzyle et phénylméthanethiosulfinate de S-benzyle (pétivéricine ; PhCH2S(O)SCH2Ph)[6]. Les zeylanoxydes sont les thiosulfinates cycliques contenant un cycle de 1,2-dithiolane-1-oxyde, qu'on trouve notamment dans les mauvaises herbes tropicales Sphenoclea zeylanica. Ces thiosulfinates héterocycliques sont chiraux au niveau du carbone comme du soufre[7]. L'acide asparagusique S-oxyde[8] et le brugiérol[9] sont d'autres 1,2-dithiolane-1-oxydes naturels présent dans Asparagus officinalis et Brugiera conjugata, respectivement.
Propriétés
L'allicine, ou phénylméthanethiosulfinate de S-benzyle, et les thiosulfinates apparentés montrent une activité antioxydante, piégeant les radicaux, associée à la facile formation d'acide sulfénique[10]. Les thiosulfinates acycliques présents dans les espèces Allium et Brassica possèdent une activité antimicrobienne, antiparasitaire, antitumorale et activité inhibitrice des protéases à cystéine, alors que les 1,2-dithiolane-1-oxydes sont des inhibiteurs de croissance. Les thiosulfinates présent dans Petiveria montrent une activité antimicrobienne[11]. Les thiosulfinates présentent un centre S(IV) lié à un centre S(II), ce dernier étant stéréogène. La conversion de disulfures simples en thiosulfinates provoque un affaiblissement considérable de la liaison S–S, de 16,7 à 8,25 kJ·mol-1pour la liaison S-S de PhS(O)SPh[12], avec pour conséquence le fait que la plupart des thiosulfinates sont à la fois instables et très réactifs. Pour cette raison, les mélanges de thiosulfinates présents dans les plantes Allium peuvent être séparés plus efficacement par CLHP à température ambiante que par chromatographie en phase gazeuse (CPG), même si cette dernière peut être utilisée avec certains thiosulfinates à basse masse moléculaire. Les thiosulfinates peuvent être distingués des sulfoxydes par spectroscopie infrarouge, car ils la bonne absorption caractéristique de la liaison S=O à environ 1 078 cm−1 au lieu de 1 030–1 060 cm-1 pour les sulfoxydes[13].
Formation et réactions
Une première synthèse de thiosulfinates a été rapporté en 1947 par Cavallito et ses collègues par oxydation des disulfures correspondants[14]. Un exemple de thiosulfinate stable est le dérivé di ter-butyle, (CH3)3CS(O)SC(CH3)3, qui peut être obtenu optiquement pur par oxydation asymétrique et catalytique du di-ter-butyldisulfure avec l'eau oxygénée (H2O2)[15]. Sous chauffage, (CH3)3CS(O)SC(CH3)3 se décompose en acide tert-butanethiosulfoxylique (CH3)3CSSOH), comme l'ont montrés des études par piège[16]. De façon similaire, un racémique de méthanethiosulfinate de méthyle (CH3S(O)SCH3) peut être obtenu via l'oxydation de disulfure de diméthyle par l'acide peracétique[17]. Le méthanethiosulfinate de méthyle se décompose thermiquement en donnant l'acide méthanesulfénique (CH3SOH), le plus simple des acides sulféniques, et le thioformaldéhyde (CH2=S). Le méthanethiosulfinate de méthyle peut aussi se dismuter en un mélange 1:1 de disulfure de diméthyle et de méthanethiosulfonate de méthyle (CH3SO2SCH3) et se réarranger via un réarrangement de Pummerer en CH3S(=O)CH2SSCH3[18] - [19]. Un thiosulfinate cyclique inhabituel à trois atomes (un dithiirane 1-oxyde) a été obtenu par réarrangement d'un 1,3-dithiétane[20]. Un composé apparenté, le 3-(9-triptycyl)dithiirane 1-oxyde, a été préparé par réaction entre le (9-triptycyl)diazométhane et S8O. La cristallographie aux rayons X du dithiirane 1-oxide a révélé une liaison soufre-soufre allongée (2,119(3)Å)[21]. Les thiosulfinates ont aussi été évoqués comme intermédiaires dans l'oxydation des thiols en acides sulfoniques.
Notes et références
- Kice JL, « Mechanisms and reactivity in reactions of organic oxyacids of sulfur and their anhydrides », Advances in Physical Organic Chemistry, vol. 17, , p. 65–181 (DOI 10.1016/S0065-3160(08)60128-8)
- T Takata, « Thiosulphinic acids and esters », The Chemistry of Sulphinic Acids, Esters and Their Derivatives, S. Patai, Ed., no John Wiley, NY, , p. 527–575
- S Braverman, « Alkanethiosulfinic Acid Esters », Sci. Synth., vol. 39, , p. 229–235
- R Kubec, « Applications of DART Mass Spectrometry in Allium Chemistry. (Z)-Butanethial S-Oxide and 1-Butenyl Thiosulfinates and their S-(E)-1-Butenylcysteine S-Oxide Precursor from Allium siculum », J. Agric. Food Chem., vol. 58, no 2, , p. 1121–1128 (PMID 20047275, DOI 10.1021/jf903733e)
- E Block, « Applications of Direct Analysis in Real Time–Mass Spectrometry (DART-MS) in Allium Chemistry. 2-Propenesulfenic and 2-Propenesulfinic Acids, Diallyl Trisulfane S-Oxide and Other Reactive Sulfur Compounds from Crushed Garlic and Other Alliums », J. Agric. Food Chem., vol. 58, no 8, , p. 4617–4625 (PMID 20225897, DOI 10.1021/jf1000106)
- R Kubec, « S-Substituted cysteine derivatives and thiosulfinate formation in Petiveria alliacea--Part II », Phytochemistry, vol. 61, , p. 675–680 (DOI 10.1016/S0031-9422(02)00328-X, lire en ligne)
- N Hirai, « Allelochemicals of the tropical weed Sphenoclea zeylanica », Phytochemistry, vol. 55, , p. 131–140 (DOI 10.1016/S0031-9422(00)00264-8)
- H Yanagawa, « Asparagusic acid-S-oxides, new plant growth regulators in etiolated young asparagus shoots », Tetrahedron Letters, vol. 14, , p. 1073–1075 (DOI 10.1016/S0040-4039(01)95907-6)
- A Kato, « Brugierol and isobrugierol, trans- and cis-1,2-dithiolane-1-oxide, from Brugiera conjugata », Tetrahedron Letters, vol. 13, , p. 203–206 (DOI 10.1016/S0040-4039(01)84280-5)
- PT Lynett, « The mechanism of radical-trapping antioxidant activity of plant-derived thiosulfinates », Org. Biomol. Chem., vol. 9, , p. 3320–3330 (DOI 10.1039/c1ob05192j)
- S Kim, « Antibacterial and antifungal activity of sulfur-containing compounds from Petiveria alliacea », Journal of Ethnopharmacology, vol. 104, , p. 188–192 (DOI 10.1016/j.jep.2005.08.072, lire en ligne)
- P Koch, « Thermal disproportionation of aryl arenethiolsulfinates. Kinetics and mechanism », J. Am. Chem. Soc., vol. 92, , p. 5971–5977 (DOI 10.1021/ja00723a026)
- (en) Block E, Garlic and Other Alliums : The Lore and the Science, Royal Society of Chemistry, , 454 p. (ISBN 978-0-85404-190-9 et 0-85404-190-7, lire en ligne)
- LD Small, « Alkyl thiolsulfinates », J. Am. Chem. Soc., vol. 69, , p. 1710–1713 (DOI 10.1021/ja01199a040)
- (RS)-(+)-2-Methyl-2-Propanesulfinamide [tert-Butanesulfinamide], Daniel J. Weix and Jonathan A. Ellman; Organic Syntheses, 2005, vol. 82, p. 157.
- E Block, « The Chemistry of Alkyl Thiosulfinate Esters. III. tert-Butanethiosulfoxylic Acid », J. Am. Chem. Soc., vol. 94, , p. 644–645 (DOI 10.1021/ja00757a060)
- TL Moore, « The Reaction of Methanesulfenyl Chloride with Alkoxides and Alcohols. Preparation of Aliphatic Sulfenate and Sulfinate Esters », J. Org. Chem., vol. 31, , p. 3587–3592 (DOI 10.1021/jo01349a027)
- E Block, « The Chemistry of Alkyl Thiosulfinate Esters. VI. Preparation and Spectral Studies », J. Am. Chem. Soc., vol. 96, , p. 3921–3929 (DOI 10.1021/ja00819a033)
- E Block, « The Chemistry of Alkyl Thiosulfinate Esters. VII. Mechanistic Studies and Synthetic Applications », J. Am. Chem. Soc., vol. 96, , p. 3929–3944 (DOI 10.1021/ja00819a034)
- A Ishii, « First isolable dithiiranes: 3-(1,1,3,3-tetramethyl-4-oxo-4-phenylbutyl)-3-phenyldithiirane 1-oxides », J. Am. Chem. Soc., vol. 115, , p. 4914–4915 (DOI 10.1021/ja00064a072)
- A Ishii, « Synthesis and reactions of a monosubstituted dithiirane 1-oxide, 3-(9-triptycyl)dithiirane 1-oxide », Tetrahedron, vol. 61, , p. 6693–6699 (DOI 10.1016/j.tet.2005.05.017)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Thiosulfinate » (voir la liste des auteurs).