Système immunitaire des muqueuses
Le système immunitaire des muqueuses est la partie du système immunitaire responsable de la protection des muqueuses (notamment des systèmes gastro-intestinal, urinaire et respiratoire).
Placé à l'interface avec le monde extérieur, il réalise la « police des frontières » de l'organisme, par opposition à la réaction immunitaire systémique réalisée à l'intérieur des tissus. Contrairement à ce dernier, son action passe essentiellement par la production d'anticorps, les immunoglobulines A sécrétoires, qui n'activent pas ou très peu le système du complément. De ce fait, son activité n'entraîne pas d'inflammation.
Les structures et mécanismes propres à l'immunité des muqueuses comprennent notamment les tissus lymphoïdes associés aux muqueuses (dont les plaques de Peyer) et les immunoglobulines A sécrétoires. Le système immunitaire muqueux assure trois fonctions principales :
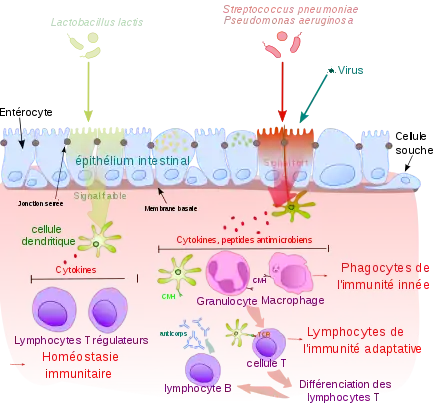
- Il sert de première ligne de défense du corps contre les antigènes et les infections.
- Il empêche des réponses immunitaires systémiques aux bactéries commensales et aux antigènes alimentaires (principalement des protéines alimentaires dans le tissu lymphoïde associé à l'intestin, ce qu'on appelle la tolérance orale).
- Il régule les réponses immunitaires appropriées aux agents pathogènes rencontrés quotidiennement.
Dans les états sains, le système immunitaire muqueux offre une protection contre les agents pathogènes, mais maintient une tolérance envers les microbes commensaux non nocifs et les substances environnementales bénignes.
Mécanisme de protection
Veille des cellules dendritiques
Les muqueuses sont le lieu d'entrée de la plupart des pathogènes[1].
Le système immunitaire a développé la cellule dendritique, la cellule spécialisée du système immunitaire permettant de capter et de présenter l’antigène aux lymphocytes[2] - [3]. Les cellules dendritiques sont principalement présentes dans la peau, les muqueuses bronchiques, intestinales et de l'appareil génito-urinaire. Elles sont également présentes dans les ganglions lymphatiques, interceptant les pathogènes ayant réussi à échapper aux cellules dendritiques périphériques, et dans la rate pour les pathogènes pénétrant directement dans le sang[4].
En périphérie, les cellules dendritiques immatures détectent la présence de signaux inflammatoires et de motifs moléculaires associés aux pathogènes. Cette reconnaissance se fait par des récepteurs particuliers qui sont les récepteurs de reconnaissance de motifs moléculaires comme les récepteurs de type Toll. Les différentes sous-populations de cellules dendritiques ne portent pas les mêmes récepteurs, ce qui leur permet de réagir à certains types de signaux.
La réception de ces signaux constituant des signaux de maturation, provoque une augmentation transitoire de l’activité phagocytaire : l'antigène est alors internalisé (phagocytose, macropinocytose) et dégradé sous forme de peptides. Les cellules dendritiques migrent ensuite vers les ganglions lymphoïdes secondaires, via les vaisseaux lymphatiques. Elles arrivent à maturité dans les organes lymphoïdes, où elles présentent les peptides de l’antigène aux lymphocytes T et B naïfs, sous forme de peptides sur le complexe majeur d'histocompatibilité (CMH).
Activation du système immunitaire adaptatif
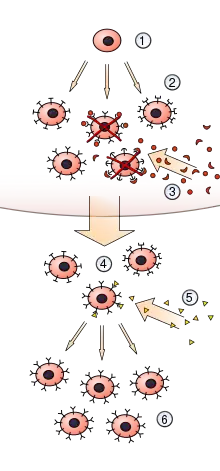
Pour que la réponse immunitaire adaptative reconnaisse, élimine, et se « rappelle » les multiples antigènes exprimés par les multiples agents infectieux rencontrés au cours de l'existence, le système immunitaire doit pouvoir reconnaître un très grand nombre d'antigènes différents. À la naissance, un vertébré génère de façon aléatoire une immense diversité de lymphocytes, dont chacun exprime un récepteur antigénique unique, et prépare ainsi l'organisme à reconnaître un nombre quasiment illimité d'antigènes différents. Un être humain est à priori capable de produire près de mille milliards d'anticorps différents.
Les différents peptides issus de la dégradation sont suffisamment courts pour pouvoir être reconnus par l'un ou l'autre des récepteurs, tout en étant suffisamment longs pour rester spécifiques d'un agent pathogène particulier. Par exemple, sachant qu'il existe 20 acides aminés distincts chez les mammifères, le nombre de peptides différents formés de seulement dix résidus d'acides aminés vaut un peu moins de 1,668 × 1013, soit près de 16 680 milliards.
Le répertoire immunitaire est l'ensemble formé par les lymphocytes B et T ayant un récepteur membranaire spécifique pour un pathogène. Seule une partie du répertoire des lymphocytes peut reconnaître un antigène donné, par conséquent seule une partie du répertoire des lymphocytes est activée par un antigène donné dans un contexte infectieux.
L'activation va produire des Lymphocyte T auxiliaire, spécialisés dans la reconnaissance de l'antigène et le déclenchement de la réponse immunitaire, des Lymphocytes T, spécialisés dans la destruction des cellules infectées, et des Lymphocytes B, spécialisés dans la fabrication d'anticorps.
Production d'anticorps

La fonction essentielle d'un anticorps produit par l'organisme est de se lier spécifiquement à un antigène, tout ou partie d'un agent pathogène extérieur. Lorsque notre système immunitaire est confronté à un pathogène envahissant, le type prédominant d'anticorps qu'il produit ensuite dépend de la localisation de ce pathogène.
Il existe différents types d'anticorps utilisés par le système immunitaire humain ; dont les principaux sont les immunoglobulines M, G et A (IgM, IgG et IgA).
- Les IgM sont générées dans les premiers stades d'une réponse immunitaire adaptative. Elle sont non spécifiques d'un microbe, car la sécrétion ne nécessite pas l'intervention d'un lymphocyte T auxiliaire.
- Les anticorps spécifiques d'un microbe particulier sont les IgG et IgA (et IgE) car leur sécrétion dépend de l'activation d'un lymphocyte T CD4.
- Si l'agent pathogène est rencontré dans la circulation sanguine ou à l'intérieur des tissus du corps, le système immunitaire produira ensuite principalement des immunoglobulines G (IgG), qui s'accumuleront dans la circulation sanguine.
- Si l'agent pathogène est introduit par les voies respiratoires (par exemple les narines) ou digestives, le système immunitaire produira principalement des immunoglobulines A (IgA), et plus spécifiquement, des IgA sécrétoires (sIgA).
Les immunoglobulines A sécrétoires (sIgA) se présentent sous forme de dimères. On les retrouve dans les muqueuses, dans les sécrétions glandulaires et de type mucus, en particulier dans la salive, les larmes, le lait maternel (colostrum), les sécrétions nasales, les sécrétions gastrointestinales et celles du tractus respiratoire. Le plus important (quantitativement) de ces tissus est le tissu lymphoïde associé au tube digestif.
Outre ces sIgA, une réponse immunitaire déclenchée par une infection des voies respiratoires générera également des IgG et des IgA dans la circulation sanguine, ce qui constitue une protection en cas de rupture des barrières des voies respiratoires et de pénétration des agents pathogènes dans les tissus. Dans les voies respiratoires inférieures, c'est-à-dire les bronches et les alvéoles pulmonaires, on trouve en complément quelques IgG cohabitant avec les IgA.
Neutralisation des pathogènes

En bleu, Chaîne lourde avec une région variable (VH) suivie d'une région constante (CH1), une région charnière, et deux autres régions constantes (CH2 and CH3).
En vert, Chaîne légère avec une région variable (VL) et une constante (CL)
Les anticorps ont la capacité de reconnaître et de se fixer de manière spécifique sur un antigène. Cette spécificité est conférée par la présence de domaines extrêmement variables aux extrémités des anticorps.
Les anticorps SIgA agissent ainsi sur divers agents pathogènes, y compris les virus, en les neutralisant, inhibant leur capacité à adhérer et envahir les cellules épithéliales[5]. Cette neutralisation implique à la fois le domaine variable et le domaine constant des IgA. Le domaine variable des IgA se fixe dans des régions spécifiques des toxines ou des microorganismes et empêche, par leur encombrement stérique, leur interaction avec des récepteurs de l'épithélium[6].
Le domaine constant des IgA, quant à lui, contient des motifs polysaccharidiques mimant des récepteurs de l'épithélium, avec lesquels pourraient se fixer les toxines ou les microorganismes[6]. Les anticorps agglutinent les pathogènes qui, inactivés et devenus trop gros, ne peuvent plus traverser la barrière muqueuse. Les toxines ou les microorganismes recouverts par les IgA sont ainsi maintenus dans le mucus, et sont éliminés progressivement par péristaltisme.
Les immunoglobulines A (IgA) forment une barrière empêchant la plupart des pathogènes de se lier aux cellules des muqueuses et de l'épiderme. Les sIgA peuvent généralement maîtriser l'infection et arrêter la transmission de ces germes en toute sécurité.
Spécificité des immunoglobulines A
Les cellules cytotoxiques, de par leur nature, ne peuvent empêcher l'infection : elles détruisent les cellules déjà infectées et réduisent ainsi la propagation de l'infection. Une réponse à base d'IgG est suivie d'une réaction immunitaire inflammatoire, déclenchée par un changement dans la forme moléculaire de la région Fc (la queue) des anticorps IgG, ce qui les amène à activer les cellules inflammatoires ainsi que le système du complément sérique.
En revanche, la liaison des anticorps sIgA aux antigènes (tels que les virus ou les bactéries) conduit à une expulsion "silencieuse" de ces agents pathogènes du corps, sans provoquer de réponses immunitaires dommageables. Les IgAs peuvent également inhiber les effets inflammatoires d'autres immunoglobulines[7]. L'IgA est un faible activateur du système du complément et n'opsonise que faiblement. Comme nos voies respiratoires rencontrent constamment des virus et des bactéries dans l'air que nous inhalons, la réponse immunitaire spécifiquement fondée sur les IgA permet d'éviter les inflammations inutiles et répétées dans nos voies respiratoires.
Acquisition péri-natale
À la naissance, le système immunitaire muqueux du nouveau-né est relativement peu développé, mais la colonisation de la flore intestinale favorise son développement[8].
Dans l'intestin, la production d'IgA est fortement induite au cours de la colonisation des nouveau-nés par la flore intestinale, acquise au cours de l'accouchement et dans les heures qui suivent[9].
Le lait maternel contient des anticorps (immunoglobulines A transmis au bébé via l'allaitement, sous une forme favorisant l'immunité des muqueuses[10].
Immunologie
En bref, sIgA est le principal anticorps sur lequel le système immunitaire s'appuie pour constituer la première ligne de défense contre les agents pathogènes, au niveau de la muqueuse. En raison de son statut de première ligne au sein du système immunitaire, le système immunitaire muqueux est à l'étude pour une utilisation dans des vaccins contre diverses affections[11], y compris le SIDA[12] - [13] - [14] - [15] et les allergies[16].
- « Il est surprenant de constater qu'en dépit de notre niveau actuel de compréhension du système immunitaire muqueux commun, presque tous les vaccins actuels sont administrés aux humains par voie parentérale. L'immunisation systémique est essentiellement inefficace pour l'induction de réponses immunitaires muqueuses. Étant donné que la majorité des micro-organismes infectieux sont rencontrés à travers les surfaces muqueuses, il est logique de considérer l'induction d'anticorps protecteurs et de réponses cellulaires T dans les tissus muqueux. »[17]
Presque tous les efforts de développement d'un vaccin contre le COVID-19 se concentrent sur l'injection systémique, qui induit principalement des anticorps IgG circulatoires et, potentiellement, des cellules T cytotoxiques[5]. La recherche se focalise sur les anticorps circulants ; cependant ceux-ci ne peuvent être efficaces dans la prévention d'une infection ou d'une maladie contractée via les muqueuses que s'ils atteignent les surfaces muqueuses où le virus est présent. Or les IgA circulantes, même sous forme polymérique, ne sont pas efficacement transportées dans les sécrétions.
Non seulement les IgG circulant dans le sang ne sont pas de nature à prévenir l'infection par les muqueuses, mais de leur côté, les IgG dérivées du plasma qui atteignent la muqueuse sont par nature inflammatoires dans leur mode d'action[5]. De ce fait, une réponse immunitaire basée sur les IgG peut provoquer des réponses inflammatoires nocives, notamment de graves lésions tissulaires dans les voies respiratoires[5]. En outre, contrairement aux immunoglobulines A sécrétoires, les anticorps IgG commencent par se lier aux particules virales, puis aux récepteurs des cellules immunitaires. Quand il n'a pas été préalablement inactivé, faute d'une charge suffisante d'anticorps, le virus peut alors pénétrer dans ces cellules, et se répliquer en leur sein, mécanisme connu sous le nom de Facilitation de l'infection par des anticorps[18].
Notes et références
- Kenneth M. Murphy, Paul Travers et Mark Walport, Janeway's immunobiology, 7e édition, Garland Science, 2008, p. 459 (ISBN 0-8153-4123-7).
- (en) R. M. Steinman et M. D. Witmer, « Lymphoid dendritic cells are potent stimulators of the primary mixed leukocyte reaction in mice », Proceedings of the National Academy of Sciences, vol. 75, no 10, , p. 5132–5136 (ISSN 0027-8424 et 1091-6490, PMID 154105, PMCID PMC336278, DOI 10.1073/pnas.75.10.5132, lire en ligne, consulté le )
- Jacques Banchereau, Francine Briere, Christophe Caux et Jean Davoust, « Immunobiology of Dendritic Cells », Annual Review of Immunology, vol. 18, no 1, , p. 767–811 (ISSN 0732-0582, DOI 10.1146/annurev.immunol.18.1.767, lire en ligne, consulté le )
- Trombetta ES, Mellman I. « Cell biology of antigen processing in vitro and in vivo. » Annu Rev Immunol. 2005;23:975-1028.
- M. W. Russell et al.: Mucosal Immunity in COVID-19: A Neglected but Critical Aspect of SARSCoV-2 Infection. Front. Immunol. 11 (2020). doi: 10.3389/fimmu.2020.611337.
- (en)Mantis NJ, Rol N, Corthésy B., Secretory IgA's complex roles in immunity and mucosal homeostasis in the gut., dans Mucosal Immunol. 2011 Nov;4(6):603-11. doi: 10.1038/mi.2011.41.Lien PubMed
- « Mucosal immunity and vaccines », Nature Medicine, vol. 11, no 4 Suppl, , S45-53 (PMID 15812489, DOI 10.1038/nm1213)
- N. Torow, B. J. Marsland, M. W. Hornef et E. S. Gollwitzer, « Neonatal mucosal immunology », Mucosal Immunology, vol. 10, no 1, , p. 5–17 (ISSN 1935-3456, PMID 27649929, DOI 10.1038/mi.2016.81
 )
) - (en)Macpherson AJ, Harris NL., Interactions between commensal intestinal bacteria and the immune system., dans Nat Rev Immunol. 2004 Jun;4(6):478-85. Lien PubMed
- (en) Per Brandtzaeg, « The Mucosal Immune System and Its Integration with the Mammary Glands », The Journal of Pediatrics, vol. 156, no 2, , S8–S15 (DOI 10.1016/j.jpeds.2009.11.014, lire en ligne, consulté le )
- Mucosal Immunity and Vaccines, August 2003
- V Pavot, N Rochereau, P Lawrence, MP Girard, C Genin, B Verrier et S Paul, « Recent progress in HIV vaccines inducing mucosal immune responses. », AIDS, vol. 28, no 12, , p. 1701–18 (PMID 25009956, DOI 10.1097/qad.0000000000000308, S2CID 28618851)
- Aldar S. Bourinbaiar, Orapun Metadilogkul et Vichai Jirathitikal, « Mucosal AIDS Vaccines », Viral Immunology, vol. 16, no 4, , p. 427–45 (PMID 14733732, DOI 10.1089/088282403771926274)
- Pavla Simerska, Peter M. Moyle, Colleen Olive et Istvan Toth, « Oral Vaccine Delivery - New Strategies and Technologies », Current Drug Delivery, vol. 6, no 4, , p. 347–58 (PMID 19534712, DOI 10.2174/156720109789000537)
- Dmytro S. Silin, Oksana V. Lyubomska, Vichai Jirathitikal et Aldar S. Bourinbaiar, « Oral vaccination: where we are? », Expert Opinion on Drug Delivery, vol. 4, no 4, , p. 323–40 (PMID 17683247, DOI 10.1517/17425247.4.4.323, S2CID 24924596)
- C. Wild, M. Wallner, K. Hufnagl, H. Fuchs, K. Hoffmann-Sommergruber, H. Breiteneder, O. Scheiner, F. Ferreira et U. Wiedermann, « A recombinant allergen chimer as novel mucosal vaccine candidate for prevention of multi-sensitivities », Allergy, vol. 62, no 1, , p. 33–41 (PMID 17156339, DOI 10.1111/j.1398-9995.2006.01245.x, S2CID 9883901)
- J. R. McGhee et al.: The mucosal immune system: from fundamental concepts to vaccine development. Vaccine 10 (1992), 75–88. doi: 10.1016/0264-410x(92)90021-b.
- H. Ulrich et al.: [ Dengue Fever, COVID-19 (SARS-CoV-2), and Antibody-Dependent Enhancement (ADE): A Perspective]. Cytometry A 97 (2020), 662–667. .