Synthèse de Corey-Winter
En chimie organique, la synthèse de Corey-Winter, élimination de Corey-Winter ou fragmentation de Corey-Winter est une réaction utilisée pour la synthèse d'alcènes à partir de 1,2-diols.[1] - [2]. Elle est nommée d'après ses découvreurs, le chimiste américain Elias James Corey (prix Nobel de chimie 1990) et le chimiste américano-estonien Roland Arthur Edwin Winter[3].
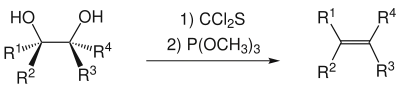
La réaction utilise pour cette conversion le phosphite de triméthyle et le thiophosgène, mais ce dernier, du fait de sa toxicité similaire à celle du phosgène, est souvent remplacé par le thiocarbonyldiimidazole, une alternative bien plus sûre.
Mécanisme réactionnel
Le mécanisme réactionnel généralement retenu implique l'attaque nucléophile des deux oxygène des fonctions alcool sur le carbone du thiophosgène, formant un thiocarbonate cyclique avec élimination de deux équivalents chlorure d'hydrogène. L'étape suivante est une attaque nucléophile du phosphite de triméthyle sur le soufre formant un carbanion[4]. La réaction finit par produire un groupe partant S=P(OMe)3, laissant carbène cyclique, la force motrice étant la création d'une forte liaison double P=S. Ce carbène, très instable, se fragmente avec la perte d'un dioxyde de carbone, donnant l'alcène souhaité.
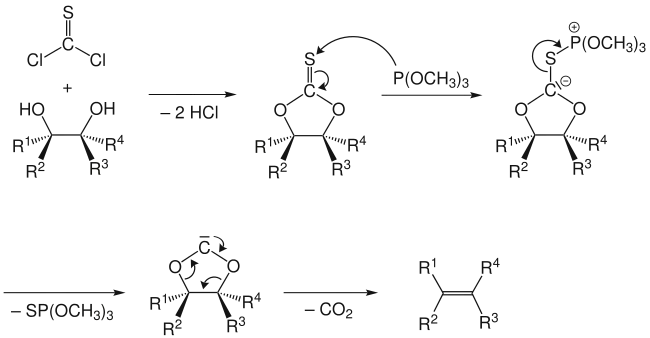
Un mécanisme alternatif a été proposé. Dans celui-ci, il n'est pas question d'un intermédiaire carbène libre, mais plutôt de l'attaque du carbanion par une seconde molécule de phosphite de trimethyle avec clivage concomitant de la liaison soufre-carbone. Le carbanion stabilisé par le phosphore subit alors une élimination pour donner l'alcène et un phosphite d'acyle qui se décarboxyle pr 'a suite.
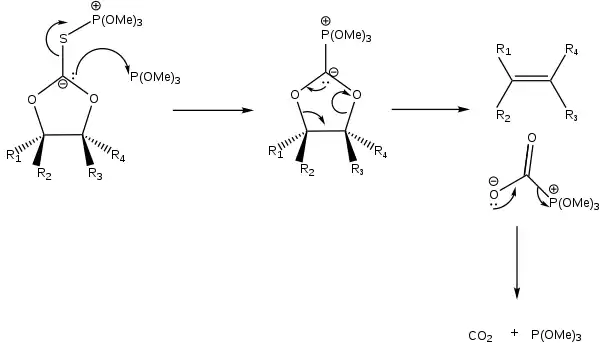
Propriétés
La synthèse de Corey-Winter est syn-sélective, ce qui signifie que lors de la première étape de réaction, pour former le cycle à cinq membres, une rotation autour de la liaison carbone-carbone dans la molécule de départ doit avoir lieu jusqu'à ce que les deux groupes OH soient en position syn ou soient éclipsés l'un par rapport à l'autre. La nature de l'alcène produit (Z ou E) dépendra ainsi de la géométrie des carbones de la liaison avant réaction : si les substituants R1 et R4, ou alors R2 et R3 sont prioritaires, l'alcène produit sera Z sera produit. Dans les deux autres cas (R1/R3 ou R2/R4 prioritaires), ce sera l'alcène E.
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Corey-Winter-Eliminierung » (voir la liste des auteurs).
- E. J. Corey, Roland A. E. Winter, « A New, Stereospecific Olefin Synthesis from 1,2-Diols », Journal of the American Chemical Society, vol. 85, no 17, , p. 2677–2678 (DOI 10.1021/ja00900a043)
- E. J. Corey, B. Hopkins, « A mild procedure for the conversion of 1,2-diols to olefins. », Tetrahedron Letters, vol. 23, no 19, , p. 1979–1982 (DOI 10.1016/S0040-4039(00)87238-X).
- Eric Block, « Olefin Synthesis by Deoxygenation of Vicinal Diols. », Organic Reactions, vol. 30, no 2, , p. 457–5662 (DOI 10.1002/0471264180.or030.02))
- Derek Horton, Charles G. Tindall, « Synthesis and reactions of unsaturated sugars. XI. Evidence for a carbenoid intermediate in the Corey-Winter alkene synthesis. », The Journal of Organic Chemistry, vol. 35, no 10, , p. 3558–3559 (DOI 10.1021/jo00835a082).