Thiocarbonate
Les thiocarbonates sont une famille d'anions de formule générale CS3-xOx2− (x = 0, 1, ou 2). Le terme désigne aussi leur sels et les composés organiques qui en dérivent.
Comme le dianion carbonate, le thiocarbonate est planaire, avec le carbone au centre. L'ordre de liaison moyen de C à S our O est de 1,33. L'état de protonation n'est en général pas précisé. Ces anions sont de bons nucléophiles et de bons ligands[1].
Monothiocarbonate
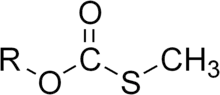
Le monothiocarbonate est le dianion CO2S2−, qui possède une symétrie de type C2v . Il peut être produit par hydrolyse du thiophosgène ou par réaction entre une base et un sulfure de carbonyle :
- COS + 2 NaOH → Na2CO2S + H2O
Dithiocarbonate
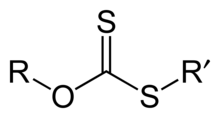
Le dithiocarbonate est le dianion COS22−, qui possède une symétrie de type C2v. Il peut être produit par réaction d'une base aqueuse avec le disulfure de carbone :
- CS2 + 2 NaOH → Na2COS2 + H2O
Les plus importants dithiocarbonates sont probablement les dérivés organiques. Les xanthates sont des composés organosulfurés préparés par réaction entre un alcoolate et le disulfure de carbone. Des dithiocarbonates organiques électroniquement neutres, de formule (RS)2CO, sont aussi connus, souvent obtenus par hydrolyse du trithiocarbonate organique correspondant. On peut citer ainsi la tétrathiapentalènedione, un hétérocycle constitué de deux groupes dithiocarbonate.
Trithiocarbonate
Le trithiocarbonate est le dianion CS32−, qui possède une symétrie de type D3h. Le trithiocarbonate est obtenu par réaction entre une source en sulfure et le disulfure de carbone[2] :
- CS2 + 2 NaSH → Na2CS3 + H2S
Perthiocarbonate
L'ajout de soufre aux trithiocarbonates donne l'anion perthiocarbonate CS42−, qui contient une liaison soufre-soufre[3]. L'acide perthiocarbonique (ou acide tétrathiocarbonique)[4]) n'a jamais été synthétisé sous forme pure, seulement sous la forme d'une solution marron foncé[5].
Notes et références
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. (ISBN 0-12-352651-5).
- R. E. Strube, Trithiocarbodiglycolic Acid, Org. Synth., coll. « vol. 4 », , p. 967(a procedure for synthesis of K2CS3
- Sodium perthiocarbonate o PubChem
- http://www.ebuychem.com/product/13074-70-9.html
- http://sulphur.atomistry.com/perthiocarbonic_acid.html
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Thiocarbonate » (voir la liste des auteurs).