Surébullition
La surébullition est l'état d'un liquide maintenu à une température supérieure à son point d'ébullition sans bouillir. Il est obtenu par chauffage d'une substance homogène dans un récipient propre, pauvre en sites de nucléation (donc en aspérités), et en prenant soin de ne pas agiter le liquide. C'est un état dit métastable : une petite perturbation peut suffire pour déclencher abruptement l'ébullition.
Un état apparenté, appelé surfusion, existe pour une matière qui demeure en phase liquide alors que sa température est inférieure à son point de solidification.
Description
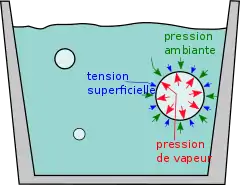
On dit que l'eau « bout » lorsque des bulles de vapeur d'eau y croissent sans limite, jusqu'à éclater à la surface. Pour qu'une bulle de vapeur se mette à croître, la température doit être suffisamment élevée pour que la pression de vapeur dépasse la pression ambiante (la pression atmosphérique, principalement). En dessous de cette température, une bulle de vapeur d'eau va rétrécir puis disparaître.
La surébullition est une exception à la règle : un liquide peut être parfois observé en état de non-ébullition en dépit du fait que la pression de vapeur soit supérieure à la pression ambiante. Cela est dû à une force supplémentaire, la tension superficielle, qui rend la croissance des bulles impossible[1].
La tension superficielle fait se comporter les bulles de vapeur comme des ballons de baudruche (et plus précisément comme des ballons sous-gonflés de sorte que le caoutchouc soit encore élastique) : la pression à l'intérieur des ballons est légèrement supérieure à la pression ambiante du fait des parois élastiques qui se rétractent. La température doit être légèrement supérieure au point d'ébullition afin de générer assez de pression de vapeur pour compenser la pression ambiante et la tension superficielle et ainsi permettre aux bulles de s'expanser.
Le caractère explosif de la surébullition provient du fait qu'une grande bulle croît plus facilement qu'une petite, tout comme lorsqu'on souffle dans un ballon, où le plus difficile est de commencer. Il s'avère que l'excès de pression induit par la tension superficielle est inversement proportionnelle au diamètre de la bulle[2]. Cela signifie que si les plus grandes bulles contenues dans un récipient ne dépassent pas quelques micromètres de diamètre, surmonter la tension superficielle peut nécessiter de dépasser le point d'ébullition de plusieurs degrés. Une fois qu'une bulle commence à se développer, la pression induite par la tension superficielle diminue en conséquence, de sorte à se qu'elle se développe de façon exponentielle. Dans la pratique, la plupart des récipients ont des rayures ou autres imperfections qui constituent des poches d'air pour le départ des bulles. Mais un liquide contenu dans un récipient sans imperfection et des bulles microscopiques peut être en proie à des phénomènes de surébullition spectaculaires.
Usages
On emploie de l'eau en surébullition dans l'extraction de soufre par le procédé Frasch. Le phénomène de surébullition de l'hydrogène liquide est utilisée dans les chambres à bulles.
Cas domestiques
La surébullition peut se produire quand un récipient contenant de l'eau non-agitée est chauffé dans un four à micro-ondes. Au moment où le récipient est retiré, le manque de sites de nucléation empêche l'ébullition, laissant la surface au repos. Cependant, une fois l'eau perturbée, certaines bulles de vapeur peuvent se former dans une réaction explosive, pouvant projeter de l'eau bouillante hors de son contenant[3]. L'ébullition peut être déclenchée par des à-coups sur le récipient, l'insertion d'un dispositif d'agitation, ou l'ajout d'une substance comme du café instantané ou du sucre. La probabilité de surébullition est plus grande avec des récipients lisses, du fait de l'absence de rayures ou d'éclats servant de points de nucléation. La surébullition survient plus favorablement après avoir répété des cycles de chauffe et de refroidissement sur un récipient dont le contenu n'est pas agité, ou lorsqu'une tasse à café oubliée est réchauffée sans avoir été retirée du four entre la chauffe et la réchauffe. Cela est dû à des cycles de chauffe libérant des gaz dissous dans le solvant (l'eau) tels que l'oxygène ou l'azote.
Il existe des moyens simples d'éviter la surébullition dans un four à micro-ondes, comme le fait de mettre un bâtonnet à glace dans le récipient ou d'utiliser un contenant aux surfaces rugueuses.
Une croyance populaire voudrait que la surébullition ne puisse se produire que dans les substances les plus pures, ce que dément l'observation du phénomène dans le café et autres liquides impurs. Les impuretés peuvent effectivement prévenir la surébullition s'ils introduisent des sites de nucléation (zones rugueuses où le gaz y est piégé) : par exemple, le sable a tendance à supprimer le phénomène de surébullition de l'eau. Les gaz dissouts peuvent également fournir des sites de nucléation lorsqu'ils se vaporisent et forment des bulles. Cependant, une impureté, comme du sel ou du sucre dissout dans l'eau, forme une solution homogène et n'empêche donc en rien la surébullition. D'autres liquides sont connus pour la surchauffe, dont le lait demi-écrémé et le lait d'amande[4].
Voir aussi
Références
- Critical Droplets and Nucleation, Cornell Solid State Lab.
- Atmosphere-ocean Interaction By Eric Bradshaw Kraus, Joost A. Businger Published by Oxford University Press US, 1994 (ISBN 0-19-506618-9), pg 60.
- Urban Legends Reference Pages: Superheated Microwaved Water.
- Beaty, William et U. Washington, « Impure water can also undergo superheating. Any superheated liquid can be dangerous so when superheating exercise caution » (consulté le ).
Liens externes
- Vidéo d'eau en surébullition dans un four à micro-ondes.
- Louis A. Bloomfield, « A series of superheated water with oil film experiments done in the microwave by Louis A. Bloomfield, physics professor at the University of Virginia. Experiment #13 proceeds with surprising violence ».
- Vidéo de surébullition de l'eau dans une casserole.