Superinfecteur
Un superinfecteur, une superinfectrice[1], ou encore un superpropagateur, une superpropagatrice (en anglais : superspreader), est un individu particulièrement contagieux dans le contexte d'une épidémie. L'étude des superinfecteurs relève notamment de l'épidémiologie qui distingue de multiples facteurs : baisse de l'immunité collective, survenue d'infections nosocomiales, augmentation de la virulence ou de la charge virale, durée d'apparition des symptômes, erreurs de diagnostic, dynamique des flux d'air, déficit immunitaire et co-infection avec un autre pathogène[2].
La transmission épidémique est souvent conforme à la règle empirique du 20/80[3], où environ 20% des individus infectés sont responsables de 80% des transmissions[4]. Autrement dit, la majorité des individus infectent relativement peu de contacts secondaires.
Un individu est déclaré superinfecteur quand il contamine davantage de patients que le prévoit le taux de reproduction de base R0, nombre moyen d'infections secondaires causées par une personne infectieuse typique dans une population totalement sensible[5]. Le calcul du taux reproductif de base est compliqué, mais on l'appréhende souvent en liant le nombre moyen de contacts et la probabilité moyenne qu'un individu sensible soit infecté, ce qui est appelé le potentiel de diffusion[4]: R0 = nombre de contacts × potentiel de diffusion.
Autrement dit, un individu est déclaré superinfecteur quand son taux de reproduction individuel est supérieur au taux de reproduction de base. Ici, le taux de reproduction individuel représente le nombre d'infections secondaires causées par un individu spécifique pendant le temps où cet individu est infectieux. Certains individus ont un taux individuel significativement plus élevé que la moyenne et sont déclarés superinfecteurs. Ainsi, lors de l'épidémie de SRAS de 2003, le chiffre de 8 contaminations par personne est défini comme le seuil de définition d'un superinfecteur[6].
Grâce à des enquêtes de proximité, les épidémiologistes ont identifié dans le passé les superinfecteurs de rougeole, de tuberculose, de rubéole, de variole du singe, de variole, de fièvre hémorragique Ebola et de SRAS[4] - [7]
Les superinfecteurs peuvent présenter ou non des symptômes de la maladie[8] - [9].
Il n'est toujours pas évident de savoir si ce sont des individus qui sont superinfecteurs, ou s'ils se retrouvent dans des situations stochastiques de superpropagation comme dans la COVID-19.
Facteurs de super-infection
Virulence et charge virale
Certains superinfecteurs excrètent un nombre supérieur à la normale d'agents pathogènes. Cela provoque l'exposition de leurs contacts à des charges virales ou bactériennes plus élevées que celles observées dans les contacts de personnes infectées typiques avec la même durée d'exposition[10].
Co-infections avec d'autres agents pathogènes
Pour définir un superinfecteur, le rôle des co-infections avec d'autres agents pathogènes est important. Ainsi, dans le cas du VIH, les hommes séropositifs qui ont été co-infectés avec au moins une autre maladie sexuellement transmissible, comme la gonorrhée, l'hépatite C et le virus de l'herpès, se sont révélés avoir un taux de transmission du VIH huit fois plus élevé que les hommes sans co-infection. Ce taux de transmission est calculé chez les hommes ayant des charges virales VIH similaires. Une fois le traitement de la co-infection terminé, le taux d'élimination du VIH revient à des niveaux comparables à ceux des hommes sans co-infection[11] - [12].
Absence d'immunité collective
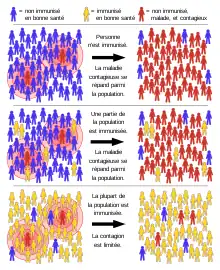
L'immunité de groupe, ou effet de groupe, fait référence à la protection indirecte que les membres de la communauté vaccinés fournissent aux membres non immunisés pour prévenir la propagation de maladies contagieuses. Plus le nombre d'individus vaccinés est élevé, moins une épidémie peut se produire car il y a moins de contacts sensibles. En épidémiologie, l'immunité collective est connue comme un phénomène dépendant car elle influence la transmission dans le temps. Comme un agent pathogène qui confère une immunité aux survivants se déplace dans une population sensible, le nombre de contacts sensibles diminue. Même s'il reste des individus sensibles, leurs contacts sont susceptibles d'être immunisés, empêchant toute nouvelle propagation de l'infection[10] - [13] La proportion d'individus immunisés dans une population au-dessus de laquelle une maladie peut ne plus persister est le seuil d'immunité collective . Sa valeur varie en fonction de la virulence de la maladie, de l'efficacité du vaccin et du paramètre de contact pour la population[14]. Cela ne veut pas dire qu'une épidémie ne peut pas se produire, mais elle sera limitée[15] - [16].
Exemples de superinfecteurs
Pandémie de Covid-19
Lors de l'épidémie de maladie à coronavirus de 2019-2020[17], certains cas de superinfecteurs sont mis en avant pour expliquer la propagation de la maladie.
- En Corée du Sud, une « Patiente 31 » est identifiée comme superinfectrice : elle avait participé à plusieurs rassemblements religieux à Daegu à l'église Shincheonji de Jésus. Selon le maire de Daegu, le nombre de cas suspects au 21 février 2020 est de 544 parmi les 4 400 fidèles examinés de l'église[18].
- Aux États-Unis, un avocat contamine au moins vingt personnes autour de lui à New Rochelle, créant un foyer actif d'au moins 100 malades[19], représentant plus de la moitié des cas de coronavirus du SRAS-2 dans l'État à un moment donné[20].
- En Inde, un prédicateur revenu d'Italie et d'Allemagne ne s'est pas mis en quarantaine. Dix-neuf de ses proches sont testés positifs. Craignant une épidémie, le gouvernement indien impose la quarantaine à 40 000 habitants de 20 villages dans l'État du Punjab[21].
- Des situations de superpropagation, plus que des individus superinfecteurs, seraient possiblement responsables d'un nombre important des contaminations de COVID19, avec un mode de transmission stochastique, selon l'analyse de transmission par grappes ou clusters[22].
Épidémie de SRAS en 2002-2004
.svg.png.webp)
Les premiers cas de SRAS se produisent à la mi-novembre 2002 dans la province chinoise du Guangdong. L'épidémie éclate à Hong Kong en février 2003. Un médecin de la province du Guangdong, qui y avait traité des cas de SRAS, y contracte le virus. Malgré ses symptômes, il se rend à Hong Kong pour assister à un mariage. Il séjourne au neuvième étage de l'hôtel Metropole à Kowloon, infectant 16 autres clients de l'hôtel se trouvant au même étage. Après la cérémonie, les invités du mariage se dispersent au Canada, à Singapour, à Taïwan et au Viêt Nam, propageant le SRAS à ces endroits et créant une épidémie mondiale[23].
Dans un autre cas, au cours de cette même épidémie, un homme de 54 ans est admis dans un hôpital pour maladie coronarienne, insuffisance rénale chronique et diabète de type 2. Il a été en contact avec un patient connu pour souffrir du SRAS. Peu de temps après son admission, il développe de la fièvre, de la toux, des myalgies et des maux de gorge. Le médecin l'admettant soupçonne un cas de SRAS. Le patient est transféré dans un autre hôpital pour le traitement de sa maladie coronarienne. Là-bas, le SRAS s'aggrave. On a découvert plus tard qu'il a transmis le SRAS à 33 autres patients en seulement deux jours. Il est transféré à l'hôpital d'origine où il décède du SRAS.
L'épidémie de SRAS est finalement maîtrisée, mais pas avant d'avoir causé 8 273 cas et 775 décès. Dans les deux semaines suivant l'épidémie d'origine dans la province du Guangdong, le SRAS s'était propagé à 37 pays[24].
Épidémie de rougeole en 1989
La rougeole est un virus aérien très contagieux qui réapparaît même parmi les populations vaccinées. Dans une ville finlandaise en 1989, une flambée explosive en milieu scolaire fit 51 cas, dont plusieurs avaient déjà été vaccinés. Un seul enfant en infecta 22 autres. Il a été noté au cours de cette épidémie que lorsque des frères et sœurs vaccinés partageaient une chambre avec un frère infecté, sept sur neuf étaient également infectés[25].
La fièvre typhoïde en 1901-1915

La fièvre typhoïde est une maladie spécifique à l'homme causée par la bactérie Salmonella typhi . Elle est très contagieuse et est souvent résistante aux antibiotiques[26]. S. typhi est susceptible de créer des porteurs asymptomatiques. L'histoire a retenu le nom de deux superinfecteurs: Mary Mallon, connue sous le nom de « Typhoid Mary » à New York (à l'origine de 51 contaminations de 1902 à 1909), et MN the Milker, de Folkstone, en Angleterre (à l'origine de plus de 200 contaminations de 1901 à 1915)[27]. À la demande des autorités sanitaires, MN renonce à travailler dans les services alimentaires. Mallon est observante au début, choisissant un autre travail, mais elle retourne finalement en cuisine et provoque de nouvelles contaminations. Elle est mise en quarantaine à North Brother Island à New York, où elle reste jusqu'à sa mort en novembre 1938, à l'âge de 69 ans[28].
Il a été constaté que Salmonella typhi persiste dans les macrophages de souris infectées qui sont passées d'un état inflammatoire à un état non inflammatoire. Les bactéries restent et se reproduisent sans provoquer d'autres symptômes chez la souris, ce qui explique pourquoi les porteurs sont asymptomatiques[29] - [30] - [31] - [32]
Références
- « superinfecteur », sur granddictionnaire.com (consulté le )
- Stein, « Superspreaders in Infectious Disease », International Journal of Infectious Diseases, vol. 15, no 8, , p. 510–513 (PMID 21737332, DOI 10.1016/j.ijid.2010.06.020)
- Galvani et May, « Epidemiology: Dimensions of superspreading », Nature, vol. 438, no 7066, , p. 293–295 (PMID 16292292, DOI 10.1038/438293a, Bibcode 2005Natur.438..293G)
- Lloyd-Smith, Schreiber, Kopp et Getz, « Superspreading and the effect of individual variation on disease emergence », Nature, vol. 438, no 7066, , p. 355–359 (PMID 16292310, DOI 10.1038/nature04153, Bibcode 2005Natur.438..355L)
- Galvani et Robert M., « Epidemiology: Dimensions of super-spreading », Nature, vol. 438, no 7066, , p. 239–295 (PMID 16292292, DOI 10.1038/438293a, Bibcode 2005Natur.438..293G)
- Z. Shen, F. Ning, W. Zhou, L.He, C. Lin, D. Chin, Z. Zhus, A. Schuchat. Superspreading events, Beijing, 2003. Emerging Infectious Diseases. Vol. 10, No. 2. Feb. 2004.
- De Serres, Markowski, Toth, Landry et al., « Largest measles epidemic in North America in a decade–Quebec, Canada, 2011: contribution of susceptibility, serendipity, and superspreading events », J Infect Dis, vol. 207, no 6, , p. 990–998 (PMID 23264672, DOI 10.1093/infdis/jis923)
- Stein, « Super-spreaders in infectious diseases », International Journal of Infectious Diseases, vol. 15, no 8, , e510–e513 (PMID 21737332, DOI 10.1016/j.ijid.2010.06.020) :
« The minority of individuals who infect disproportionately more susceptible contacts, as compared to most individuals who infect few or no others, became known as super-spreaders, and their existence is deeply rooted in history: between 1900 and 1907, Typhoid Mary infected 51 individuals, three of whom died, even though she only had an asymptomatic infection. »
- David C. Wiley et Amy C. Cory, Encyclopedia of School Health, Los Angeles, Calif., SAGE, , 707 p. (ISBN 978-1-4129-9600-6)
« Historically, one of the most famous examples of super-spreading was that of Mary Mallon, better known as Typhoid Mary, who infected many contacts, several of whom died, through food she prepared and consequently contaminated, even thought she did not show symptoms. »
- Kenneth J. Rothman, Sander Greenland, and Timothy L. Lash. Modern Epidemiology, 3rd Edition. 2008. page 561. Lippincott, Williams & Wilkins. Philadelphia.
- Cohen, IF, Royce, Kazembe et al., « Reduction of concentration of HIV-1 in semen after treatment of urethritis: implications for prevention of sexual transmission of HIV-1. AIDSCAP Malawi Research Group », Lancet, vol. 349, no 9069, , p. 1868–73 (PMID 9217758, DOI 10.1016/s0140-6736(97)02190-9)
- Winter, Taylor, White et Ross, « Asymptomatic urethritis and detection of HIV-1 RNA in seminal plasma », Sex Transm Infect, vol. 75, no 261, , p. 261–3 (PMID 10615314, PMCID 1758225, DOI 10.1136/sti.75.4.261)
- Fine, « Herd immunity: history, theory, practice », Epidemiol Rev, vol. 15, no 2, , p. 265–302 (PMID 8174658, DOI 10.1093/oxfordjournals.epirev.a036121)
- Priorities in Health : Disease Control Priorities Companion Volume, World Bank Publications, , 217 p. (ISBN 0-8213-6260-7, lire en ligne), « Chapter 4: Cost-Effective Strategies for the Excess Burden of Disease in Developing Countries
Section: Vaccine-preventable Diseases » - Yeung LF1, Lurie P, Dayan G, Eduardo E, Britz PH, Redd SB, Papania MJ, Seward JF.A limited measles outbreak in a highly vaccinated US boarding school. Pediatrics. 2005 Dec;116(6):1287-91.
- Paul Fine. Ken Eames. David L. Heymann. Herd Immunity:A Rough Guide. Clinical Infectious Dis. (2011) 52 (7). 911-916.
- (en-GB) James Gallagher, « Coronavirus super-spreaders: Why are they important? », BBC News, (lire en ligne, consulté le )
- Hyonhee Shin et Sangmi Cha, « 'Like a zombie apocalypse': Residents on edge as coronavirus cases surge in South Korea », Thomson Reuters, (lire en ligne [archive du ], consulté le )
- Sheena Jones and Christina Maxouris CNN, « New York officials traced more than 50 coronavirus cases back to one attorney », sur CNN (consulté le )
- Eric Levenson and Kristina Sgueglia CNN, « New York creates 'containment zone' around cluster of coronavirus cases in New Rochelle », sur CNN (consulté le )
- (en-GB) « India 'super spreader' quarantines 40,000 people », BBC News, (lire en ligne, consulté le )
- « COVID-19 : "La seule chose qui compte, c'est l'endroit où s'qu'elle tombe" ou comment éviter une éventuelle deuxième vague », sur VIDAL (consulté le )
- « How SARS changed the world in less than six months » [archive du ] (consulté le )
- Shen et Fang Ning, « Superspreading SARS Events, Beijing 2003 », Emerging Infectious Diseases, vol. 10, no 2, , p. 256–260 (PMID 15030693, PMCID 3322930, DOI 10.3201/eid1002.030732)
- Paunio, Peltola, Davidkin et Virtanen, « Explosive School-based Measles Outbreak Intense Exposure May Have Resulted in High Risk, Even among Revaccinees », Am J Epidemiol, vol. 148, no 11, , p. 1103–10 (PMID 9850133, DOI 10.1093/oxfordjournals.aje.a009588)
- (en) « Typhoid is with us to stay », The Daily Telegraph, (lire en ligne, consulté le )
- Mortimer, PP. ‘Mr. N. the Milker and Dr. Koch's concept of the healthy carrier’. The Lancet. 1999; 353:1354–56.
- Marr, J. Typhoid Mary. The Lancet. 1999; 353:1714
- TM, Ng, DM Monack. Revisiting Caspase-II Function in Host Defense. Cell Host & Microbe. 17 July 2013. 14(1). pp. 9-14.
- JS Cox, L.Lam, L. Mukundan, A. Chawla, DM Monack. Salmonella Require the Fatty Acid Regulator PPAR. Cell Host & Microbe. 14 August 2013. 14(2) pp. 171-182.
- « Typhoid Mary case may be cracked, a century later », Los Angeles Times, (lire en ligne, consulté le )
- « Bacteria study offers clues to Typhoid Mary mystery », The New York Times, (lire en ligne, consulté le )
Voir aussi
Articles connexes
Liens externes
- OMS - Source officielle d'informations sur les problèmes de santé dans le monde
- Pandémies passées qui ont ravagé l'Europe
- CDC: Phases de pandémie de grippe
- Centre européen de prévention et de contrôle des maladies - ECDC
- « Page sur les problèmes éthiques de l'American Journal of Bioethics dans les pandémies »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- Vidéo TED-Education - Comment les pandémies se propagent
- Photos de l'hôpital abandonné Photos et histoire de l'hôpital Riverside abandonné