Sulfure de titane(III)
Le sulfure de titane(III) est un composé chimique de formule Ti2S3. Il se présente comme un solide noir cristallisé dans le système hexagonal selon une structure proche de celle de l'arséniure de nickel (de) (groupe d'espace P63/mmc ; no 194) dans laquelle le titane a une coordinence égale à 6[2]. Il reste stable dans l'air et dans l'eau à température ambiante de sorte qu'il ne sent pas le sulfure d'hydrogène, contrairement au disulfure de titane TiS2. Attaqué par l'acide sulfurique à chaud, il commence par former une suspension gris bleuté avant de se dissoudre complètement en une solution incolore, tandis qu'il forme des solutions vertes avec l'acide nitrique ou l'acide sulfurique concentré froid. Il libère de l'H2S lorsqu'il est attaqué par l'acide chlorhydrique chaud[5].
| Sulfure de titane(III) | |
| |
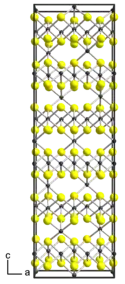
| __ Ti __ S Structure cristalline du sulfure de titane(III)[1] |
|
| Identification | |
|---|---|
| Nom systématique | sulfure de titane(III) |
| Synonymes |
trisulfure de dititane |
| No CAS | |
| PubChem | 19601280 |
| SMILES | |
| InChI | |
| Apparence | poudre noire[2] |
| Propriétés chimiques | |
| Formule | S3Ti2 |
| Masse molaire[3] | 191,929 ± 0,017 g/mol S 50,12 %, Ti 49,88 %, |
| Propriétés physiques | |
| Masse volumique | 3,684 g/cm3[4] |
| Unités du SI et CNTP, sauf indication contraire. | |
On peut obtenir le sulfure de titane(III) en chauffant du TiS2 sous vide à 1 000 °C[2] ou en le réduisant avec de l'hydrogène à haute température[5]. Il peut également être préparé à partir des éléments sous pression et à 800 °C[5].
Notes et références
- (en) M. Onoda, M. Saeki et I. Kawada, « Superstructures of Ti2S3 (4H) », Zeitschrift für anorganische und allgemeine Chemie, vol. 457, no 1, , p. 62-74 (DOI 10.1002/zaac.19794570107, lire en ligne).
- (de) A. F. Holleman, E. Wiberg et N. Wiberg, Lehrbuch der Anorganischen Chemie, 102e éd., Walter de Gruyter, Berlin, 2007, p. 1525. (ISBN 978-3-11-017770-1)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) Jean D'Ans et Ellen Lax, « Elemente, anorganische Verbindungen und Materialien, Minerale », Taschenbuch für Chemiker und Physiker, vol. 3, Springer, 1997, p. 770. (ISBN 978-3-540-60035-0)
- (de) Gmelins Handbuch der anorganischen Chemie: Titan, Verlag Chemie, 1971. (ISBN 978-3527841028)