Sphingosine kinase
Une sphingosine kinase (SphK) est une enzyme (en l'occurrence une kinase[N 1]) qui catalyse la conversion de la sphingosine en sphingosine-1-phosphate (S1P : un sphingolipide de signalisation cellulaire, qui agit comme un médiateur lipidique bioactif) par phosphorylation[1] (addition d'un groupe phosphoryle —PO32−).
Dans la nomenclature EC, les sphingosine kinases portent la référence EC 2.7.1.91.
Historique
La sphingosine kinase a été isolée la première fois en 1970 par des chercheurs de l'université d'Illinois, elle a été détectée du fait de son activité catalytique[2].
Caractéristiques
SphK a été mise en évidence dans les cellules d'espèces vivantes très diverses : mammifères, reptiles, poissons, nématodes, protozoaires… avec une forte conservation de la séquence d'acides aminés[3].
On connaît deux isoenzymes de sphingosine kinases dans les cellules des mammifères, elles sont désignées par « sphingosine kinase type 1 » (SphK1) et « sphingosine kinase type 2 » (SphK2).
Chez l'humain, SphK1 est composé de 384 résidus d'acides aminés pour une masse de 42,5 kDa, SphK2 est composé de 618 résidus d'acides aminés pour une masse de 65,2 kDa[4].
SphK1 est une kinase cytoplasmique alors que SphK2 est située dans le noyau, le réticulum endoplasmique et les mitochondries[5]. SphK2 comporte un signal de localisation nucléaire à son extrémité N-terminale[6].
SphK1 est fortement exprimée dans la rate, les poumons et les leucocytes, alors que SphK2 est fortement exprimée dans le foie et les reins[7]
Des recherches menées sur des souris ont montré que l'absence de SphK de type 1 et de type 2 avaient des conséquences mortelles, alors que l'absence de SphK d'un seul type n'était pas mortelle[8].
Génomique
Chez l'humain, le gène de SphK1 est situé sur le chromosome 17 q25.1 (sous-bande 1 de la bande 5 de la région 2 du bras long)[9], le gène de SphK2 est situé sur le chromosome 19 en position q13.33 (sous-bande 33 de la bande 3 de la région 1 du bras long)[10]. Les deux isoenzymes ont chacune plusieurs isoformes.
Activité
La sphingosine est composée d'une chaîne de 18 atomes de carbone et d'une fonction amino-alcool (appelée base sphingoïde) : ![]()
Le groupe hydroxyle (—OH) fixé sur le carbone en C1 va être substitué par un groupement —O—PO3−H lors de la phosphorylation par la sphingosine kinase pour obtenir la sphingosine-1-phosphate : 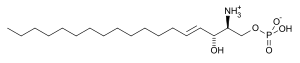
Le groupe phosphoryle (—PO32−) est obtenu à partir d'une molécule d'ATP (Adénosine triphosphate) : 
À l'issue de la synthèse, la molécule d'ATP s'est transformée en molécule d'ADP (Adénosine diphosphate) : 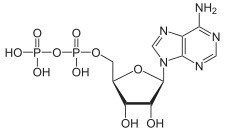
La sphingosine 1-phosphate (S1P) est un médiateur de la signalisation cellulaire. L'activation de SphK et la production de S1P ainsi sécrétée dans le sérum sanguin des mammifères, constituent de ce fait une étape essentielle dans de nombreux mécanismes de signalisation cellulaire[4].
Notes
- Une kinase est une enzyme du groupe des transférases qui catalyse les réactions de phosphorylation par l'ajout d'un ion phosphate à une molécule cible, à partir de l'ATP
Références
- Alemany R, van Koppen CJ, Danneberg K, Ter Braak M, Meyer Zu Heringdorf D. Regulation and functional roles of sphingosine kinases. Naunyn Schmiedebergs Arch Pharmacol. 2007 Feb;374(5-6):413-28. doi: 10.1007/s00210-007-0132-3. Epub 2007 Jan 23. .
- Carlos B. Hirschberg, A. Kisic, G.J. Schroepfer Jr., Enzymatic Formation of Dihydrosphingosine 1-Phosphate, Journal of Biological Chemistry, Chemistry and Metabolism of Substances of Low Molecular Weight, vol., numéro 12, p. 3084-3090, 25 juin 1970, DOI:https://doi.org/10.1016/S0021-9258(18)63025-X
- Sarah Spiegel, Sheldon Milstien, Sphingosine-1-phosphate: an enigmatic signalling lipid, Nature Reviews Molecular Cell Biology (en), 4, 397–407 01/05/2003, https://doi.org/10.1038/nrm1103
- Alessandro Cannavo, Daniela Liccardo, Klara Komici, Graziamaria Corbi, Claudio de Lucia, Grazia D. Femminella, Andrea Elia, Leonarfo Bencivenga, Nicola Ferrara, Walter J. Koch, Nazareno Paolocci, Giuseppe Rengo, Sphingosine Kinases and Sphingosine 1-Phosphate Receptors: Signaling and Actions in the Cardiovascular System, Frontiers in Pharmacology, vol. 8, 23/08/2017, pp. 556, DOI=10.3389/fphar.2017.00556, (ISSN 1663-9812), consulter en ligne
- Diaz Escarcega Rocio, McCullough Louise D., Tsvetkov Andrey S., The Functional Role of Sphingosine Kinase 2, Frontiers in Molecular Biosciences, vol. 8, 2021, pp. 428, DOI=10.3389/fmolb.2021.683767, (ISSN 2296-889X), lire en ligne.
- Nobuaki Igarashi, Taro Okada, Shun Hayashi, Toshitada Fujita, Saleem Jahangeer, Shun-ichi Nakamura, Sphingosine Kinase 2 Is a Nuclear Protein and Inhibits DNA Synthesis, The Journal of biological chemistry, 278(47), 46832–46839, 21/11/2003, https://doi.org/10.1074/jbc.M306577200
- Hatoum D, Haddadi N, Lin Y, Nassif NT, McGowan EM, Mammalian sphingosine kinase (SphK) isoenzymes and isoform expression: challenges for SphK as an oncotarget, Oncotarget, 2017 ; 8(22):36898-36929, doi:10.18632/oncotarget.16370
- Jim Wang, Stefan Knapp, Nigel J. Pyne, Susan Pyne, Jonathan M. Elkins, Crystal Structure of Sphingosine Kinase 1 with PF-543, ACS Medicinal Chemistry Letters, 27 octobre 2014, 5(12):1329-33. https://doi.org/10.1021/ml5004074
- Fiche sur le gène SphK1 sur le site genenames.org
- Fiche sur le gène SphK2 sur le site genenames.org