Spectrométrie d'absorption atomique
En chimie analytique, la spectrométrie d'absorption atomique (Atomic absorption spectroscopy en anglais ou SAA) est une technique de spectroscopie atomique servant à déterminer la concentration des éléments métalliques (métaux alcalins, alcalino-terreux, métaux de transition) ainsi que les métalloïdes dans un échantillon. Ceux-ci sont atomisés à l'aide d'une flamme alimentée d'un mélange de gaz ou d'un four électromagnétique[1]. La sensibilité de ce dernier est plus importante que la flamme et permet de quantifier les éléments recherchés de l'ordre du ppb. En 2010, c'est une méthode monoélémentaire, chaque élément à doser necessite une source de lumière caractéristique. Elle fait partie des méthodes classiques d’analyse en chimie analytique. Basée sur des méthodes optiques, elle conduit aussi bien à des résultats qualitatifs qu'à des données quantitatives. L'absorption est utilisée généralement pour faire un dosage, l'élément est connu, on détermine une concentration.

L'analyse se base sur l’absorption de photons par des atomes à l'état fondamental, et on utilise à cet effet en général des solutions sauf dans le cas des hydrures. Une préparation est donc souvent nécessaire : dissolution d'un alliage par exemple.
Bien que cette technique date du XIXe siècle, sa forme moderne fut développée dans les années 1950 par des chimistes australiens, menés par Alan Walsh et travaillant à la Division of Chemical Physics du CSIRO à Melbourne[2].
Expériences de Kirchhoff
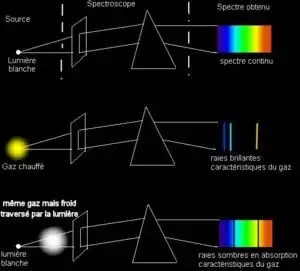
Les 3 expériences de Kirchhoff permettent de démontrer les principes de l'absorption et de l'émission atomique.
- En faisant passer à travers un prisme une lumière polychromatique on obtient un spectre continu.
- En remplaçant la lumière polychromatique par un bec Bunsen, dans lequel brûle un sel métallique, on voit apparaître les raies brillantes qui caractérise l'élément. On obtient donc le spectre d'émission de cet élément.
- En combinant les deux expériences on obtient le spectre d'absorption du sel métallique. On voit donc apparaître la même chose que dans la première expérience mis à part qu'aux endroits où on voyait apparaître les raies d'émissions de la seconde expérience on remarque des raies sombres. Ceci est dû à la présence dans la flamme d'une large proportion d'atomes restés à l'état fondamental qui absorbent les radiations lumineuses de la lumière polychromatique aux longueurs d'onde caractéristiques de l'élément, ce qui est une manifestation de l'absorption atomique.
Avantages
Elle est très sélective, il n'y a pas d'interférences spectrales ou alors elles sont connues. La technique est simple si on sait préparer les solutions initiales. Elle est très documentée. Depuis quelques années, les AAS peuvent être équipées de carrousels, permettant le passage d'un grand nombre d'échantillons avec, de plus en plus, un équipement de lampe mono- ou multi- éléments.
Limites de la technique
Pour des raisons technologiques et non de principes, certains éléments, comme les gaz rares, les halogènes... ne peuvent être analysés par spectrométrie, leur énergie d'absorption n'étant pas comprise entre 180 et 1000 nm. Les concentrations doivent être à l'échelle de traces afin de rester dans le domaine de linéarité de la loi de Beer-Lambert, car sa dynamique est limitée. L'existence d'interférences chimiques sévères complique parfois (exemple: calcium/phosphore). C'est le cas des matrices pouvant être en lien avec les domaines de l'agro-alimentaire, de certains végétaux ou encore des sols, qui s'avèrent être des solutions souvent aqueuses, salines ou organiques multi-éléments.
De plus, éléments de transitions et métalloïdes nécessitent un couplage avec un générateur d'hydrure.
Interférences
Les interférences proviennent principalement d'éléments présents dans la matrice, proche de l’élément à analyser au niveau des longueurs d'onde. Ces interférences peuvent être de l'ordre d'effets de matrices, des absorptions moléculaires, particulaires ou atomiques.
L'analyse d'un composé peut être perturbée par deux types d'interférences :
- Chimique : C'est une des interférences les plus courantes, elle est due au fait que certains sels métalliques sont difficiles à atomiser, ou qu'ils forment des composés peu volatils qui sont également difficiles à atomiser. Ce qui aura pour effet de réduire la vitesse d'atomisation ainsi que l'intensité du signal.
Pour corriger ce problème il faudrait travailler à une température plus élevée ou ajouter un complexant à l'échantillon.
- Spectrale : Cette interférence est due à la présence de particules solides qui diffusent le rayonnement de la lumière incidente dans l'atomiseur mais également à cause de la présence de produits de combustion, dont les bandes d'absorption sont larges. Ce qui a pour effet de diminuer l'intensité du signal.
Pour corriger ce problème il faudrait changer la composition du comburant ou du combustible.
Afin de limiter ou d'éliminer ces phénomènes d’interférences, il est possible d'associer les décrites ci-dessus à un paramétrage ou un développement technique de l'outil d'analyse.
Notes et références
- Waterlot Christophe, « Évaluation des effets d’une lampe à cathode creuse pulsée à courant variable sur les interférences spectrales de l’arsenic dans le dosage du cadmium par spectrophotométrie d’absorption atomique », Rev. can. genie civ.,
- L’vov, B. V., « Fifty years of atomic absorption spectrometry », Journal of Analytical Chemistry, vol. 60, , p. 382 (DOI 10.1007/s10809-005-0103-0)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Atomic absorption spectroscopy » (voir la liste des auteurs).