Saccoglossus
Saccoglossus est un genre de vers marins hémichordés de la famille des Harrimaniidae[3].
| Règne | Animalia |
|---|---|
| Sous-règne | Bilateria |
| Infra-règne | Deuterostomia |
| Embranchement | Hemichordata |
| Classe | Enteropneusta |
| Famille | Harrimaniidae |
- Dolichoglossus Spengel, 1893[2]
Description
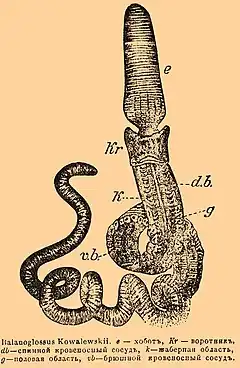
Les vers du genre Saccoglossus sont fouisseurs et creusent des tubes dans le sable et la boue. Ce sont des vers solitaires, bilatéraux et deutérostomes[4]. Leur corps est divisé en trois parties : le proboscis ou prosome qui contient des anneaux concentriques de fibres musculaires, le col et le tronc[5]. Les hémichordés sont des coelomates typiques[6]. Leur embryon est cilié et motile[7].Il s'aiderait de leur proboscis pour creuser le substrat[3].
Liste d'espèces
Selon BioLib (6 octobre 2018)[2] :
- Saccoglossus apantesis Thomas, 1956
- Saccoglossus apatensis Thomas, 1955
- Saccoglossus aulakoeis Thomas, 1968
- Saccoglossus bromophenolosus King, Giray & Kornfield, 1994
- Saccoglossus horsti Brambell & Goodhart, 1941
- Saccoglossus hwangtauensis Tchang & Koo, 1935
- Saccoglossus inhacensis Kapelus, 1936
- Saccoglossus kowalevskii Agassiz, 1873
- Saccoglossus madrasensis Rao, 1957
- Saccoglossus mereschkowski (Wagner, 1885)
- Saccoglossus mereschkowskii Wagner, 1885
- Saccoglossus otagoensis Benham, 1899
- Saccoglossus palmeri Cameron, Deland & Bullock, 2010
- Saccoglossus porochordus Cameron, Deland & Bullock, 2010
- Saccoglossus pusillus Ritter, 1902
- Saccoglossus rhabdorhyncus Cameron, Deland & Bullock, 2010
- Saccoglossus ruber Tattersall, 1905
- Saccoglossus shumaginensis Cameron, Deland & Bullock, 2010
- Saccoglossus sonorensis Cameron, Deland & Bullock, 2010
- Saccoglossus sulcatus Spengel, 1893
Histoire
Dans les années 1880, William Bateson compara l'anatomie des hémichordés et des chordés. En étudiant le développement de Saccoglossus kowalevskii, il a trouvé des similitudes entre les deux groupes[5]. Burden-Jones a par la suite examiné la queue post-anale d'un juvénile et y a également trouvé des ressemblances avec les chordés. En effet, la queue des hémichordés exprime les gènes hox11, 13a,b et c et celle des chordés exprime hox11, 12 et 13. Les deux groupes auraient ainsi des parties homologues dans cette queue post-anale, même si celle des hémichordés est contractile et que la fonction de celle des chordés sert davantage pour la nage. Leur fonction aurait divergé[5]. Par la suite, Bateson, puis Goodrich ont vu une possible homologie de la région du pore du proboscis de Saccoglossus et l'endostyle ou la thyroïde dans le pharynx des chordés[5]. Les hémichordés et les échinodermes se trouvent à être les groupes sœurs des chordés. Les trois phylums forment ensemble le supertaxon des deutérostomes[5].
Le rôle des hémichordés dans l'émergence des chordés
Il y a différentes hypothèses sur les origines des chordés et le rôle que les hémichordés comme Saccoglossus ont joué dans leur apparition. L'une d'entre elles, émise par Bateson, stipule que les chordés auraient évolué à partir de l'exagération de certaines structures des ancêtres des hémichordés puisque de nombreux caractères des hémichordés sont similaires chez les chordés. Goodrich proposa ensuite que les deux paires de cœlomes antérieurs présents chez les hémichordés aient rapetissé pour donner des somites chez les chordés et qu'il y ait eu un réarrangement des structures dorsoventrales[5].Une seconde hypothèse, l'hypothèse auriculaire émise par Garstang stipule que l'ancêtre mobile des chordés était une larve d'un ptérobranche sessile adulte. Les ptérobranches font partie des hémichordés et sont assez proches phylogénétiquement des Entéropneustes. Certains Entéropneustes ne possédant pas de stade larvaire, comme Saccoglossus, les Entéropneustes n'auraient pas pu faire partie de cette hypothèse[5]. De l'adulte, des fentes pharyngiennes, une notochorde et la maturité sexuelle ont été transférées à la larve par néoténie, formant ainsi un protochordé mobile sur la base de la larve d'un ptérobranche[5]. L'hypothèse bilatérale quant à elle met en lumière le fait que les protostomes et deutérostomes ont beaucoup de gènes en commun. Il s'agirait d'un ancêtre bilatéral complexe qui serait à la base de l'origine des chordés et des hémichordés[5]. L'hypothèse de l'inversion, quant à elle, stipule que l'ancêtre des chordés aurait un arrangement des organes similaire aux protostomes; soit un système nerveux ventral et centralisé. Un descendant dans la lignée des chordés aurait subi une inversion dorsoventralement[5].
Similarités avec les chordés
Saccoglossus kowalevskii est un modèle de comparaison du groupe des hémichordés avec les chordés. Son développement est direct et rapide ce qui permet l'établissement des principaux caractères adultes suivant quelques jours après la fertilisation à peine[4]. Les hémichordés partagent certains caractères des chordés tels qu'un tube neural, quoique celui-ci soit ventral chez Saccoglossus, des fentes pharyngiennes et une queue post anale[5]. Ils ont pour groupe frère les échinodermes et ont divergé de la lignée des tuniciers et céphalocordés vers celle des chordés il y a approximativement 530 millions d'années[8].
Les domaines de trente-huit gènes s'exprimant selon l'axe antéropostérieur du système nerveux des hémichordés sont similaires pour les chordés malgré l'aspect diffus du système nerveux embryonnaire des hémichordés. Environ 40% des domaines d'expression ne sont pas présents chez les protostomiens et auraient ainsi évolué à la suite de la différentiation des deux lignées basales[5].
En outre, les gènes exprimés dans la partie antérieure du cerveau des chordés sont présents dans le prosome des hémichordés, la partie médiane dans le mésosome et postérieure dans le métasome juste avant les premières fentes pharyngiennes. Aussi, le gène hedgehog qui a un rôle critique dans le développement du système nerveux central a subi une mutation importante chez Saccoglossus kowalevskii qui aurait diminué sont efficacité et qui expliquerait pourquoi sont système nerveux est assez diffus contrairement à celui centralisé des chordés. Toutefois, des centres de signalisation cruciaux pour le développement d'un système nerveux central sont présents chez S. kowalevskii[8]. Ainsi, un système nerveux central était probablement un caractère ancestral au deutérostome qui aurait été modifié chez Saccoglossus et les céphalocordés et qui aurait complètement disparu chez les tuniciers, les lignées voisines.
De plus, des études moléculaires démontrent que, tôt dans le développement de Saccoglossus kowalevskii, les gènes impliqués dans le modelage de l'axe dorsoventral sont homologues à ceux identifiés chez les chordés. Quoique les domaines d'expression de certains gènes le long de cet axe se rapprocheraient davantage des protostomiens que des deutérostomiens et que l'axe en question est assez difficile à déterminer puisque les hémichordés vivent à la verticale dans des tubes creusés dans le sol sablonneux ou la boue. L'axe dorsoventral aura subi d'autres modifications dans la lignée des chordés, notamment une centralisation du système nerveux comme mentionné plus haut, une ségrégation de l'épiderme, une dérivation de la notochorde et une inversion de l'organisation dorsoventrale[5]. Aussi, les cellules embryonnaires de S. kowalevskii suivent un clivage radial[4].
De plus, dans l'endoderme, les gènes paxl19 et six1 sont exprimés dans les fentes pharyngiennes des hémichordés, mais également chez les chordés. L'ancêtre des deutérostomes possédait probablement des fentes pharyngiennes qui ont par la suite été perdues chez les échinodermes[5].
La stomochorde
La notochorde des hémichordés fut renommée stomochorde ou diverticule buccal, car des études démontrèrent qu'elle n'est pas homologue à la notochorde des chordés quoique le sujet en ait longtemps été débattu[5]. En effet, certains gènes exprimés dans la notochorde des chordés ne sont pas exprimés dans la stomochorde, mais ailleurs dans l'organisme[5]. La stomochorde est composée de cellules épithéliales et proviendrait d'un diverticule de la partie dorsal de l'épithélium du pharynx[6]. Chez les chordés, la notochorde est originaire de l'endoderme dorsal, puis se sépare de celui-ci. Quoique la morphogénèse de ces deux structures soit similaire, la persistance de l'attache de la stomochorde au pharynx est vue comme une preuve de la non-homologie des structures. Chez les chordés, la notochorde s'étend de la partie la plus postérieure du corps jusqu'à l'hypophyse. Chez S. kowalevskii, la stomochorde s'étend seulement sur une courte distance dans le proboscis, mais varie chez les autres hémichordés. Le caractère le plus régulier à travers les espèces est la présence d'une matrice extracellulaire épaisse autour de la notochorde ou stomochorde. Les cellules des deux structures sont interconnectées par desmosomes, lui donnant une certaine rigidité. L'une des caractéristiques les plus importantes de la stomochorde de S. kowalevskii au niveau cytologique est la présence d'une large vacuole dans les cellules, aussi présentes chez Amphioxus, un céphalochordé, durant son développement. La vacuole est absente de la stomochorde des ptérobranches. Il y a également des cellules granuleuses dans la stomochorde des Enteropneustes. Ce trait leur est toutefois exclusif et aurait des fonctions sécrétrices[6].
Morphologie du cœur-rein de Saccoglossus
Le cœur-rein est une structure retrouvée chez les Entéropneustes, notamment les hémichordés et les ptérobranches, mais également chez leur groupe sœur, les échinodermes. On le retrouve aussi chez Saccoglossus. Sa structure chez les Entéropneustes est homologue à celle des échinodermes. Elle conserve beaucoup de similitudes entre les groupes et a des fonctions parallèles[6]. Bateson démontra en 1886 que le glomérule ou le gland du proboscis étaient formés à partir de la prolifération du protocoel au bout antérieur de la stomochorde. Le glomérule est un organe contenant beaucoup de capillaires sanguins qui est relié au sinus cardiaque entre la stomochorde et le péricardium. Le péricardium est une cavité coelomique comprenant le sinus cardiaque qui entoure presque au complet la stomochorde ventrale. Une contraction du péricardium augmente de manière significative la pression sanguine dans le sinus cardiaque et le glomérule pour permettre au sang d'être filtré. Il y a alors réabsorption d'ions et de macromolécules dans les cellules du protocoel. Le protocoel est la partie préorale du coelum du proboscis Le protocoel s'ouvre vers l'extérieur par le biais d'un pore sur le proboscis au bout d'un conduit entouré d'un épithélium de cellules multiciliées à gauche de la ligne médiane ventrale[6]. C'est par là qu'est charriée l'urine hors de l'organisme. L'épithélium multicilié de Saccoglossus est un caractère dérivé des Entéropneustes. Par contre, le caractère cilié simple des cellules péritonéales des podocytes est une condition plésiomorphique retrouvée chez les ptérobranches par exemple. Les muscles monociliés des hémichordés indiquent une condition primitive partagée par un ancêtre commun de ses groupes.
Bateson et Hyman, en 1959, ont assigné une fonction excrétoire au glomérule à cause des granules jaune et brune à l'intérieur des cellules6. Ces granules sont souvent présentes dans des structures excrétrices chez les invertébrés. Wilke note ensuite, en 1971, la présence de podocytes dans l'épithélium du glomérule. Les podocytes sont rencontrés chez les bilatéraux et sont associés au processus de filtration. Wilke suggère ensuite que le sang sous pression en provenance du cœur serait filtré au travers du glomérule. Le conduit du protocoel n'a pas été identifié comme étant une néphridie véritable, mais la fonction de filtration du glomérule est indéniable. Le cœur-rein de Saccoglossus est composé du péricardium, du sinus cardiaque, de la stomochorde et du glomérule et se retrouverait à la base du proboscis proche du point d'attachement de celui-ci et du col[6].
Développement de Saccoglossus
La biologie évolutive du développement de Saccoglossus est idéale pour mettre en valeur les caractères dérivés et ancestraux entre les groupes des hémichordés et des chordés. Le mésoderme de S. kowalevskii est dérivé des quatre cellules végétatives d'un embryon de seize cellules. Le reste du blastomère contribuera à la formation de l'ectoderme[4]. La formation de cellules neurales ou neurogénèse commence assez tôt dans le développement de Saccoglossus, soit durant la gastrulation. Les précurseurs de la neurogénèse sont même différentiés au stade de la blastula. Les futurs neurones se développent à partir de l'ectoderme[9].Des neurones immatures post-mitotiques seraient présents à la mi-gastrulation et leur maturation se déroulerait durant la fin de la gastrulation. Contrairement aux chordés, il n'y a pas de polarité dorsoventrale à ce stade. La gastrulation de S. kowalevskii est symétrique autour du blastopore[4]. Lors de la gastrulation, le pôle végétatif de l'embryon s'aplatit et se renfonce pour former l'invagination, rapprochant ainsi le pôle végétatif et animal. C'est aussi à ce stade que l'axe antéropostérieur est différentiable, se trouvant être parallèle aux deux pôles[4].
Les signaux requis pour réguler la neurogénèse chez les hémichordés ne sont pas encore bien connus, mais ceux-ci diffèrent des signaux utilisés chez les vertébrés et les échinodermes[7]. Le système nerveux embryonnaire de S. kowalevskii est diffus et transitoire. Il se réorganise par la suite pour se concentrer dans le col et la trompe chez l'organisme adulte. Le tube neural est formé dans la partie dorsale du col grâce à des invaginations qui seraient homologues au système nerveux central des chordés. Le cordon nerveux se formerait ensuite sans invagination le long de la ligne centrale de la trompe[7]. Il n'y a pas de système nerveux central, mais de nombreux axones qui se répandent dans l'épithélium en s'épaississant à la base du proboscis et le long de l'axe antérodorsal dans la région du col[9]. À la suite de la gastrulation, le mésoderme est formé d'abord en passant par un cœlome simple dans la partie antérieure, puis en paire dans la partie postérieure et, finalement, en paire dans la future région du col. Lorsque l'embryon s'allonge le long de l'axe antéropostérieur, la bouche finit par perforer la face ventrale en séparant le proboscis et le col. L'embryon commence également à fléchir dorsoventralement, permettant la détermination de cet axe. Trois jours suivant la fertilisation, les différents feuillets et axes du corps sont clairement établis et l'organisation du corps est similaire à celui de l'adulte[4].
De nombreux gènes Hox sont exprimés le long de l'axe antéropostérieur durant le développement de Saccoglossus kowalevskii. Ce sont des gènes importants pour le développement sur l'axe antéropostérieur. Hox1 est détecté tôt durant la gastrulation dans une bande de l'ectoderme antérieur à la bande ciliée du métasome et continue postérieurement à cette bande. Après le quatrième jour, son expression s'étend antérieurement sur la ligne médiane ventrale et dorsale. Le domaine endoderme d'expression de hox1 s'étend en dessous des fentes pharyngiennes dans la partie postérieure à la frontière de l'endoderme du pharynx. On retrouve une expression similaire de hox1 dans la partie antérieure de l'intestin de Drosophila et des chordés incluant amphioxus[9].L'expression de hox2 est détectée vers la fin de la gastrulation et dans un domaine similaire à hox1, mais davantage postérieur. Après le troisième jour de développement, l'expression du gène s'amenuise sur la face dorsale et se renforce sur la face ventral[9]. Hox5 est également détecté durant la gastrulation, mais aux alentours du blastopore. Après l'élongation de l'embryon suivant le deuxième jour de développement, son expression s'étant en une fine ligne dans la région postérieure et antérieure à la bande ciliée. Après le quatrième jour, à la suite du développement des fentes pharyngiennes, son expression est davantage postérieure dans l'ectoderme[9]. À ce stade, la bande ciliée est déplacée, allant d'une position postérieure et ventrale à une disposition davantage antérieure et dorsale. Hox6 et 7 ont des profils d'expression similaires antérieurs à la bande ciliée comme hox2 et 5. Durant le deuxième jour de développement, hox7 est davantage exprimé dans la partie ventrale du blastopore alors que hox6 se trouve davantage autour de celui-ci. À un stade plus avancé de développement, les deux gènes divergent. Hox6 se met à ressembler davantage à hox5 tandis que le domaine d'expression de hox7 demeure davantage ventral que dorsal[9]. Le domaine d'expression de hox9 et 10 se trouve à la limite la plus postérieure de l'embryon ainsi que dans la bande ciliée. Leur expression varie peu durant le développement et il faut attendre que les fentes pharyngiennes aient fini de se former pour noter que leur expression cesse dans la bande ciliée. Pour hox11 et 13a, ceux-ci se trouvent presque exclusivement dans l'épithélium cilié durant la presque totalité des stades de développement. Sa présence a été détectée à un stade juvénile après treize jours de développement le long de la queue post-anale[9]. Les gènes Hox trouvés chez les hémichordés sont similaires à ceux trouvés dans une espèce d'oursin de mer S. purpuratus, même si hox4 a été perdu chez ce dernier. Il est toutefois présent dans une autre classe d'échinoderme et chez les hémichordés suggérant ainsi que hox4 était présent chez un ancêtre commun deutérostome.
Les gènes hox2, 5, 6 et 7 sont tous exprimés antérieurement à la bande ciliée à un stage précoce. Ce n'est que plus tard dans le développement que des différences majeures dans leur expression respective sont détectées.
Notes et références
- Integrated Taxonomic Information System (ITIS), www.itis.gov, CC0 https://doi.org/10.5066/F7KH0KBK, consulté le 6 octobre 2018
- BioLib, consulté le 6 octobre 2018
- (en) Cameron C. B., « A revision of the genusSaccoglossus (Hemichordata: Enteropneusta: Harrimaniidae) with taxonomic descriptions of five new species from the Eastern Pacific », Zootaxa, .
- « Evolution of nodal signaling in deuterostomes: Insights from <i> Saccoglossus kowalevskii</i> - ProQuest » (consulté le )
- John Gerhart, Christopher Lowe et Marc Kirschner, « Hemichordates and the origin of chordates », Current Opinion in Genetics & Development, pattern formation and developmental mechanisms, vol. 15, no 4, , p. 461–467 (DOI 10.1016/j.gde.2005.06.004, lire en ligne, consulté le )
- (en) Elizabeth J. Balser et Edward E. Ruppert, « Structure, Ultrastructure, and Function of the Preoral Heart-Kidney in Saccoglossus kowalevskii (Hemichordata, Enteropneusta) Including New Data on the Stomochord », Acta Zoologica, vol. 71, no 4, , p. 235–249 (ISSN 1463-6395, DOI 10.1111/j.1463-6395.1990.tb01082.x, lire en ligne, consulté le )
- (en) 4. Doreen Cunningham, « Spatiotemporal development of the embryonic nervous system of Saccoglossus kawalevskii », Developmental Biology, , p. 252-263
- Arunkumar Krishnan, Markus Sällman Almén, Robert Fredriksson et Helgi B. Schiöth, « Remarkable similarities between the hemichordate (Saccoglossus kowalevskii) and vertebrate GPCR repertoire », Gene, vol. 526, no 2, , p. 122–133 (DOI 10.1016/j.gene.2013.05.005, lire en ligne, consulté le )
- (en) J. Aronowicz et C. J. Lowe, « Hox gene expression in the hemichordate Saccoglossus kowalevskii and the evolution of deuterostome nervous systems », Integrative and Comparative Biology, vol. 46, no 6, , p. 890–901 (ISSN 1540-7063, DOI 10.1093/icb/icl045, lire en ligne, consulté le )