Sabellaria alveolata
L'Hermelle (Sabellaria alveolata) est un ver (annélide) marin polychète, long de quatre centimètres, remarquable en tant que ver tubicole capable de produire des structures biogéniques dites « pseudorécifs ». Ces récifs sont en régression en certains endroits du monde.
Hermelle
| Règne | Animalia |
|---|---|
| Embranchement | Annelida |
| Classe | Polychaeta |
| Sous-classe | Palpata |
| Ordre | Canalipalpata |
| Famille | Sabellariidae |
| Genre | Sabellaria |

Étymologie
Le nom commun en français hermelle provient du grec herma (« rocher, récif »), en référence à la capacité de ce ver de construire des structures ressemblant à des récifs[2]. On le retrouve dans l'appellation scientifique (dépassée) Hermella alveolata de Quatrefages en 1865[2]. En français, d'autres termes utilisés sont la teigne et le crassier (en Vendée)[2].
Le nom scientifique Sabellaria alveolata, proposé par Linné en 1767, vient du latin sabulum (« sable ») et alveolata (« alvéolée ») renvoie à la forme des pseudorécifs d'hermelles ressemblant à des alvéoles d'abeilles[2].
Cycle de vie
Espèce bentho-pélagique, la phase larvaire de quelques semaines est pélagique et la phase adulte, durant en moyenne quatre ans, est benthique. La reproduction est sexuée gonochorique[3] avec une fécondation des gamètes qui a lieu dans le milieu marin et qui donne dans les heures qui suivent une larve trochophore de 80 μm. Elle donne dans la baie du Mont-Saint-Michel deux principaux pics de ponte qui correspondent aux deux pics de phytoplancton des milieux tempérés (une première ponte majeure en avril, et une seconde ponte en septembre)[4]. Les larves vivent 4 à 6 semaines[5] dans la colonne d'eau avant de migrer : les larves erpochètes deviennent benthiques et se fixent préférentiellement sur les tubes d'adultes en raison d'un chimiotactisme positif exercé par le ciment de ces tubes[6].
Des expériences basées sur l'observation en laboratoire de larves issues de fécondation artificielle ont recherché les facteurs (hydrodynamisme, apports de sédiments, fonds marin) favorisant la fixation sur les tubes d'adultes. Avant la métamorphose, les larves gagnent le fond ou diverses surfaces solides (coquille d'huître, cailloutis rocher)[7] ; si la larve ne trouve pas de substrat lui convenant, elle peut retarder sa métamorphose de plusieurs semaines (elle peut alors à la fois nager en plein eau et ramper sur le fond). Après un certain temps, certaines larves finissent quand même par se métamorphoser avant de mourir, ou meurent sans se métamorphoser[8].
Nutrition
Vers qui se nourrissent d'organismes de particules alimentaires organiques en les filtrant de l'eau (microphagie suspensivore), ils ont une capacité de filtration individuelle (0,35 L/heure par gramme de matière sèche) inférieure à l'huître plate européenne (0,60 L/h/ g M.S) ou la moule commune (1,30 L/h/ g M.S) mais l'extrapolation à l'échelle de l'habitat montre une capacité différente : dans la baie du Mont-Saint-Michel, le massif des hermelles a une capacité de filtration de 1.31 106 m-3/jour, les populations de moules communes cultivées ont une capacité de 0,74 106 m-3/jour (5.28 106 m-3/jour pour l'ensemble des moules) et les huîtres plates cultivées 0,02 106 m-3/jour (1,67 106 m-3/jour pour l'ensemble des huîtres)[9].
Massifs d'hermelles
Colonies
Espèce ingénieur de son écosystème, l'hermelle donne naissance à une bioconstruction dont les individus coloniaux érigent des tubes formant le massif ou récif d'hermelles. Les tubes de sable qui ont une section circulaire de 5 à 10 mm de diamètre, cimentés par une glande du ver, sont droits et forment un ensemble à l’allure buissonnante ; en effet, au cours de leur croissance, les tubes changent d’orientation selon les conditions hydrodynamiques, pouvant être horizontaux à verticaux. Ils ont une longueur maximale de 30 cm mais ils peuvent se superposer les uns aux autres, pouvant atteindre, dans des conditions favorables, une hauteur de 1,50 m[10]. Accolés les uns aux autres, ces tubes ressemblent à des gâteaux d'abeille et ils finissent par former des pseudorécifs[11] de masse souvent considérable. Ces colonies, comptant de 15 000 à 60 000 individus par mètre carré[12], constituent des massifs qui peuvent croître de 12 cm/an (le rythme de construction varie selon le piétinement, les variations thermiques ou d'hydrodynamie) et abriter 70 espèces différentes (vers, larves et juvéniles de crustacés y migrant par thigmotactisme), constituant ainsi un réservoir de biodiversité[13]. Les massifs ont la forme de coussins plus ou moins plats ou des buissons arborescents.
Les biorécifs dans la Baie du Mont Saint-Michel[14] et la baie de Bourgneuf, localement appelés crassiers, constituent le seul bioherme de grande superficie des côtes d'Europe[15].
Dynamique récifale
La dynamique du récif passe par les stades suivants : structures en boules isolées (unité récifale qui représente un modèle morphologique et structural élémentaire), structures en boules dégradées (blocs isolés et fractionnés), structures coalescentes (accolement et fusion des boules formant une barrière récifale ou un platier qui représente le « climax » de la dynamique récifale), structures coalescentes dégradées (zones éboulées sous l'action des vagues ou du piétinement), structures dégradées (forte irrégularité de la surface récifale et désorganisation des tubes), placages (tubes se développant le long du rocher dont ils épousent le contour)[16].
Les biorécifs d'hermelles du Mont-Saint-Michel
Les hermelles sont considérées comme espèce-ingénieur en raison des biorécifs qu'elles construisent, pouvant atteindre 3 km de large et environ 300 hectares, sur un mètre de hauteur[17], entre la chapelle de Sainte-Anne et la pointe de Champeaux, appelés « crassiers »[18]. C'est la plus grande bioconstruction intertidale active de toute l'Europe[19].
Le suivi du récif et les études (cartographies des paramètres suivis couplée à un indice spatialisé de santé du récif) entamées à la suite de la restructuration de la mytiliculture locale montrent cependant que ce récif de Sabellaria alveolata a beaucoup régressé et tend à se fragmenter (récif de Saint-Anne (223 ha) entre 2001 et 2007[20], et qu'il est menacé, principalement en son centre par :
- la pêche à pied (piétinement des sabellaria + modes de récolte souvent destructives pour le récif)[20] ;
- l'envasement rapide du site, causé par les bouchots[17] qui modifient les conditions hydrodynamiques et augmentent la sédimentation
- la colonisation par Crassostrea gigas (en progression dans les années 2000-2010)[20] ;
- la compétition trophique avec ces espèces concurrentes pour la nourriture[20].
La gestion intégrée des zones côtières modifie certaines implantations conchylicoles pour préserver les massifs.
Menaces

Dès 1832, des naturalistes comme Jean-Victor Audouin et Henri Milne-Edwards[21] considèrent ces récifs comme des fléaux qui enterrent les huîtres élevées, aussi recommandent-ils de récolter les hermelles comme les crépidules pour en faire des amendement calcaires. En 1916, les scientifiques Galaine et Houlbert s’inquiètent du rôle de ces récifs dans « l’assèchement » de la baie du Mont-Saint-Michel, accusés de barrer le lit des fleuves sur pas moins de 10 km (Galaine et Houlbert, 1916)[22]. Des géologues s’alarment de la « prolifération » de ces récifs, préconisant leur dynamitage ou leur érosion par dragage[23].
Ces récifs sont menacés par les pressions anthropiques directes (fragmentation des structures par piétinement, arrachage des algues épibiontes et destruction des blocs de récifs pour déloger coquillages et crustacés lors des activités de pêche à pied et indirectes (envasement du récif consécutif à la réduction de l'hydrodynamisme et à la production de pseudofeces par les élevages conchylicoles, fixation d’algues épibiontes[24] reliées avec des phénomènes d'eutrophisation)[25] - [26].
Applications potentielles
La cohésion des tubes est assurée par un cément, colle sécrétée par des glandes cémentaires au niveau de la tête et composée de protéines, de polymères et de cations divalents. Ce ciment biologique microporeux intéresse le milieu médical (application au niveau de la réparation des tissus osseux, colle dentaire) et l'industrie routière (colle écologique remplaçant le goudron)[27].
Galerie
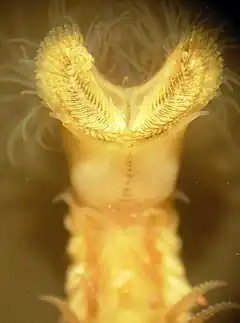
 Hermelle à la sortie de son tube.
Hermelle à la sortie de son tube. Tubes d'hermelles terminés par une petite collerette en forme d’entonnoir[28].
Tubes d'hermelles terminés par une petite collerette en forme d’entonnoir[28].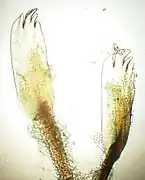 Soies palées de l'opercule.
Soies palées de l'opercule.
Voir aussi
Bibliographie
- Linné, C. von. 1767 : Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis 13th Edition. Volume 1. Stockholm. (Sabella alveolata)
- (en) Dubois S., Barillé L., Retière C. (2003) Efficiency of particle retention and clearance rate in the polychaete Saellaria alveolata L. C. R. Biologies 326, p. 413-421
- (en) Lecornu B., Schlund E., Basuyaux O., Cantat O., Dauvin J.-C. (2016) Dynamics (from 2010-2011 to 2014) of Sabellaria alveolata reefs on the western coast of Cotentin (English Channel, France). Reg. Stud. Mar. Sci., 8, p. 157-169
Liens externes
- (en) Référence Catalogue of Life : Sabellaria alveolata (Linnaeus, 1767) (consulté le )
- (fr+en) Référence ITIS : Sabellaria alveolata
- (en) Référence World Register of Marine Species : espèce Sabellaria alveolata (Linnaeus, 1767)
- (en) Référence Animal Diversity Web : Sabellaria alveolata
- (en) Référence NCBI : Sabellaria alveolata (taxons inclus)
- Les formations récifales à Sabellaria alveolata, site internet du projet REEHAB[29]
Notes et références
- « Hermelle », sur DORIS (consulté le ).
- « Sabellaria alveolata | DORIS », sur doris.ffessm.fr (consulté le )
- Le dimorphisme sexuel est marqué : la femelle est rose, le mâle est blanc.
- (en) S. Dubois, T. Comtet, Christian Retière, Éric Thiébaut, « Distribution and retention of Sabellaria alveolata larvae (Polychaeta: Sabellariidae) in the Bay of Mont-Saint-Michel, France », Marine Ecology Progress Series, vol. 346, , p. 243-254 (DOI 10.3354/meps07011).
- La mortalité par prédation de ce phytoplancton est élevée (99 % des larves meurent).
- (en) Joseph R. Pawlik, « Larval settlement and metamorphosis of two gregarious sabellariid polychaetes: Sabellaria alveolata compared with Phragmatopoma californica », Journal of Marine Biological Associationof United Kingdom, vol. 68, no 1, , p. 101-124 (DOI 10.1017/S002531540005013X).
- Le substrat meuble du massif de Champeaux masque en fait un ancien substrat solide.
- Wilson D.P (1968). The settlement behaviour of the larvae of Sabellaria alveolata (L.). Journal of the Marine Biological Association of the United Kingdom, 48(02), 387-435.(résumé)
- (en) Philippe Cugier, Caroline Struski, Michel Blanchard, Joseph Mazurié, Stéphane Pouvreau, Frédéric Olivier, Jihane R.Triguid, Eric Thiébaut, « Assessing the role of benthic filter feeders on phytoplankton production in a shellfish farming site: Mont Saint Michel Bay, France », Journal Of Marine Systems, vol. 82, nos 1-2, , p. 21-34 (DOI 10.1016/j.jmarsys.2010.02.013).
- « Les biohermes à Hermelles, exemples de constructions récifales Massif de Carolles (Sud-Manche) », sur geologie.discip.ac-caen.fr (consulté le ).
- Non constitués de squelettes, ils sont improprement appelés récifs : le terme correct est bioherme.
- [PDF] (en) Bernadette Tessier & Pierre Weill, The Bay of Mont-Saint-Michel. Facies, morphodynamics and Holocene evolution of a hypertidal coastal environment, International meeting of Sedimentology, 2017, p.13
- Dans la baie du Mont-Saint-Michel, des études ont révélé que le nombre d’espèces moyen (Annélides polychètes, crustacés, mollusques, insectes) était plus de 5 fois plus important dans les récifs que dans les sédiments meubles qui le bordent. Cf (en) Stanislas Dubois, Christian Retière, Frédéric Olivier, « Biodiversity associated with Sabellaria alveolata (Polychaeta: Sabellariidae) reefs: effects of human disturbances », Journal of the Marine Biological Association of the United Kingdom, vol. 82, no 5, , p. 817-826 (DOI 10.1017/S0025315402006185).
- Journal d'actualité 24, « Conservation des récifs d’hermelles : de l’utilité d’avoir de bons voisins et un bon patrimoine génétique », sur journal-d-actualite-24.com, (consulté le ).
- (en) Chantal Bonnot-Courtois, Bay of Mont-Saint-Michel and the Rance Estuary: Recent Development and Evolution of the Depositional Environments, éditions Technip, (lire en ligne), p. 61.
- [PDF] S. Dubois, L. Barillé, A.-L Barillé, Y. Gruet , Conditions de préservation des formations récifales à Sabellaria alveolata (L.) en baie de Bourgneuf, Université de Nantes, ISOMer, 2004, p. 17
- Espace des Sciences, « Les hermelles dans la baie du Mont-Saint-Michel », sur bretagne-biodiversite.org (consulté le ).
- G. Lucas, P. Lefevre, Contribution a l'étude de quelques sédiments marins et de récifs d'hermelles du mont Saint-Michel, Revue des Travaux de l'Institut des Pêches Maritimes (0035-2276), 1956, Vol. 20, p. 85-112
- « Complexité structurale des récifs biogéniquesd’hermelles (Sabellaria alveolata) par drone aérien », sur hal.archives-ouvertes.fr (consulté le ).
- DESROY N. Facteurs naturels et anthropiques responsables de l'évolution d'un habitat benthique côtier original : les récifs d'hermelles de la baie du Mont Saint Michel ; IFREMER Station de Dinard CRESCO, 2009, Biodiversité et environnement marin : connaissance, gestion et protection ; Colloque - Concarneau
- Recherches pour servir à l’histoire naturelle du littoral de la France, ou recueil de mémoires sur l’anatomie, la physiologie, la classification et les mœurs des animaux de nos côtes : ouvrage accompagné de planches faites d’après nature, Éd. Crochard, (lire en ligne), p. 181-182.
- G. Galaine et C. Houlbert, « Les récifs d’hermelles et l’assèchement de la baie du Mont-Saint-Michel », CR de l’Académie des Sciences, t. 163, no 21, , p. 613-616.
- [PDF] Christophe Secula. Acteurs et gestion du littoral. Une anthropologie de la baie du Mont-Saint-Michel. Anthropologie sociale et ethnologie. Museum national d’histoire naturelle - MNHN PARIS, 2011, p. 34
- Ulves et entéromorphes.
- (en) Stanislas Dubois, John A.Commito, Frédéric Olivier, Christian Retière, « Effects of epibionts on Sabellaria alveolata (L.) biogenic reefs and their associated fauna in the Bay of Mont Saint-Michel », Estuarine, Coastal and Shelf Sciences, vol. 68, nos 3-4, , p. 635-646 (DOI 10.1016/j.ecss.2006.03.010).
- (en) N. Desroy, S. F. Dubois, J. Fournier, L. Ricquiers, P. Le Mao, L. Guerin, D. Gerla, M. Rougerie, A. Legendre, « The conservation status of Sabellaria alveolata (L.) (Polychaeta: Sabellariidae) reefs in the Bay of Mont-Saint-Michel », Aquatic Conservation, vol. 21, no 5, , p. 462-471 (DOI 10.1002/aqc.1206).
- (en) Jean-Philippe Buffet, Erwan Corre, Evelyne Duvernois-Berthet, Jérôme Fournier, Pascal Jean Lopez, « Adhesive gland transcriptomics uncovers a diversity of genes involved in glue formation in marine tube-building polychaetes. Buffet, J-P, Corre, E, Duvernois-Berthet, E, Fournier, J, Lopez, PJ. », Acta Biomaterialia, vol. 72, , p. 316-328 (DOI 10.1016/j.actbio.2018.03.037).
- Cette collerette recueille l’eau de mer chargée de particules nutritives mais aussi les particules minérales (essentiellement des grains carbonatés plats) utilisées pour édifier les tubes.
- Acronyme de Reef Habitat.