STAT5
Le transducteur de signal et activateur de transcription 5 (STAT5 fait référence à deux protéines hautement apparentées, STAT5A et STAT5B, qui font partie de la famille de 7 protéines STAT. Bien que STAT5A et STAT5B soient codées par des gènes distincts, les protéines sont identiques à 90% au niveau des acides aminés[1]. Les protéines STAT5 sont impliquées dans la signalisation cytosolique et dans la médiation de l'expression de gènes spécifiques[2]. Il a été démontré que l’activité aberrante de STAT5 était étroitement liée à un large éventail de cancers chez l’homme[3] et la réduction de cette activité aberrante est un domaine de recherche active en chimie médicale[4].
Activation et fonction
Pour être fonctionnelles, les protéines STAT5 doivent d'abord être activées.Cette activation est réalisée par les kinases associées aux récepteurs transmembranaires[3].
- premièrement, les ligands se liant à ces récepteurs transmembranaires situés à l'extérieur de la cellule activent les kinases.
- deuxièmement, les kinases stimulées ajoutent un groupe phosphate à un résidu de tyrosine spécifique sur le récepteur.
- STAT5 se lie ensuite à ces tyrosines phosphorylées en utilisant leur domaine SH2 (domaines STAT illustrés ci-dessous).
- le STAT5 lié est ensuite phosphorylé par la kinase, la phosphorylation se produisant au niveau de résidus de tyrosine particuliers sur l'extrémité C-terminale de la protéine.
- la phosphorylation provoque la dissociation de STAT5 du récepteur.
- le STAT5 phosphorylé finit par former soit des homodimères, STAT5-STAT5, soit des hétérodimères, STAT5-STATX, avec d'autres protéines STAT. Les domaines SH2 des protéines STAT5 sont à nouveau utilisés pour cette dimérisation. STAT5 peut également former des homo-tétramères, généralement de concert avec l'histone méthyltransférase EZH2 et agit en tant que répresseur transcriptionnel[5].
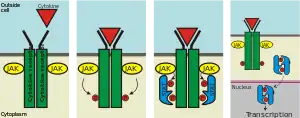
Dans la voie d'activation illustrée, le ligand impliqué est une cytokine et la kinase spécifique participant à l'activation est JAK. Le STAT5 dimérisé représente la forme active de la protéine, qui est prête pour la translocation dans le noyau.
Une fois dans le noyau, les dimères se lient aux éléments de réponse STAT5, induisant la transcription d'ensembles spécifiques de gènes. Une régulation positive de l'expression des gènes par les dimères de STAT5 a été observée pour les gènes traitant de[2] :
- croissance et division cellulaires contrôlées, ou prolifération cellulaire
- mort cellulaire programmée ou apoptose
- spécialisation cellulaire, ou différenciation
- l'inflammation .
Les dimères STAT5 activés ont cependant une courte durée de vie et sont soumis à une désactivation rapide. La désactivation peut être réalisée par une voie directe, éliminant les groupes phosphate en utilisant des phosphatases telles que PIAS ou SHP-2, ou par une voie indirecte, qui implique une réduction de la signalisation des cytokines[6].
STAT5 et les cancers
STAT5 s'est révélée être phosphorylée de manière constitutive dans les cellules cancéreuses[4] ce qui implique que la protéine soit toujours présente sous sa forme active. Cette activation constante est provoquée par des mutations ou par des expressions aberrantes de la signalisation cellulaire, entraînant une régulation médiocre, ou un manque total de contrôle, de l'activation de la transcription pour les gènes influencés par STAT5. Cela conduit à une expression constante et accrue de ces gènes. Par exemple, des mutations peuvent conduire à une expression accrue de gènes anti-apoptotiques, dont les produits empêchent activement la mort cellulaire. La présence constante de ces produits préserve la cellule malgré le fait qu'elle soit devenue cancéreuse, ce qui la rend finalement maligne.
Approches thérapeutiques
Les tentatives de traitement de cellules cancéreuses avec STAT5 phosphorylée de manière constitutive ont inclus à la fois une inhibition indirecte et directe de l'activité de STAT5 Bien que des travaux thérapeutiques supplémentaires aient été réalisés sur l'inhibition indirecte, cette approche peut entraîner une toxicité accrue des cellules et également des effets non spécifiques, qui sont tous deux mieux gérés par l'inhibition directe[4].
L'inhibition indirecte cible les kinases associées à STAT5 ou les protéases qui effectuent la troncature terminale des protéines. Différents inhibiteurs ont été conçus pour cibler différentes kinases:
- l'inhibition de BCR ABl constitue la base du fonctionnement de médicaments tels que l'imatinib [7]
- l'inhibition de FLT3 est réalisée par des médicaments tels que le lestaurtinib[8]
- L’inhibition de JAK2 est réalisée par le médicament CYT387, qui a fait l’objet d’essais précliniques et fait actuellement l’objet d’essais cliniques[9]
L'inhibition directe de l'activité de STAT5 utilise des inhibiteurs à petites molécules qui empêchent STAT5 de se lier correctement à l'ADN ou empêchent une dimérisation appropriée. L'inhibition de la liaison à l' ADN utilise l'interférence ARN[10], oligodésoxynucléotide anti-sens[10] et le petit ARN en épingle à cheveux[11]. L'inhibition de la dimérisation appropriée, par contre, est provoquée par l'utilisation de petites molécules qui ciblent le domaine SH2. Les travaux récents sur le développement de médicaments dans ce dernier domaine se sont révélés particulièrement efficaces[12].
Références
- « Stat5a and Stat5b: fraternal twins of signal transduction and transcriptional activation », Cytokine Growth Factor Rev., vol. 10, no 2, , p. 131–57 (PMID 10743504, DOI 10.1016/S1359-6101(99)00011-8)
- « STAT5 as a molecular regulator of proliferation, differentiation and apoptosis in hematopoietic cells », EMBO J., vol. 18, no 17, , p. 4754–65 (PMID 10469654, PMCID 1171548, DOI 10.1093/emboj/18.17.4754)
- « Signal transducer and activator of transcription 5A/B in prostate and breast cancers », Endocr. Relat. Cancer, vol. 15, no 2, , p. 367–90 (PMID 18508994, DOI 10.1677/ERC-08-0013, lire en ligne)
- « Inhibitors of Stat5 protein signalling », MedChemComm, vol. 3, no 1, , p. 22 (DOI 10.1039/C1MD00175B)
- « Epigenetic repression of the Igk locus by STAT5-mediated recruitment of the histone methyltransferase Ezh2 », Nat. Immunol., vol. 12, no 12, , p. 1212–20 (PMID 22037603, PMCID 3233979, DOI 10.1038/ni.2136)
- « Constitutive activation of STAT5 by the BCR-ABL oncogene in chronic myelogenous leukemia », Oncogene, vol. 13, no 2, , p. 247–54 (PMID 8710363)
- « Effects of a selective inhibitor of the Abl tyrosine kinase on the growth of Bcr-Abl positive cells », Nat. Med., vol. 2, no 5, , p. 561–6 (PMID 8616716, DOI 10.1038/nm0596-561)
- « A FLT3-targeted tyrosine kinase inhibitor is cytotoxic to leukemia cells in vitro and in vivo », Blood, vol. 99, no 11, , p. 3885–91 (PMID 12010785, DOI 10.1182/blood.V99.11.3885)
- « CYT387, a selective JAK1/JAK2 inhibitor: in vitro assessment of kinase selectivity and preclinical studies using cell lines and primary cells from polycythemia vera patients », Leukemia, vol. 23, no 8, , p. 1441–5 (PMID 19295546, DOI 10.1038/leu.2009.50)
- « Specific inhibition of Stat5a/b promotes apoptosis of IL-2-responsive primary and tumor-derived lymphoid cells », J. Immunol., vol. 171, no 8, , p. 3919–27 (PMID 14530308, DOI 10.4049/jimmunol.171.8.3919, lire en ligne)
- « Stat3 as a molecular target in RNA interference-based treatment of oral squamous cell carcinoma », Oncol. Rep., vol. 20, no 4, , p. 873–8 (PMID 18813829, DOI 10.3892/or_00000085)
- « Small molecule STAT5-SH2 domain inhibitors exhibit potent antileukemia activity », J. Med. Chem., vol. 55, no 3, , p. 1047–55 (PMID 22148584, DOI 10.1021/jm200720n)