Réflectine
Les réflectines constituent une famille de protéines complexes, capables de brusques changements de forme, qui modifient l'incidence de la lumière qu'elles réfléchissent (lumière solaire, artificielle ou provenant de l'organisme lui-même (bioluminescence[1]).
Elles ont été récemment découvertes par des universitaires californiens[2] dans les iridocytes ou iridophores du tégument de l'espèce de calmar nain (30 millimètres) Euprymna scolopes (qui vit dans le centre de l'océan Pacifique), mais ensuite retrouvée chez d'autres espèces de céphalopodes dont certaines peuvent afficher des motifs colorés éblouissants et rapidement changeants, a priori en contractant sélectivement certains muscles peauciers pour activer de façon réversible les chromatophores - cellules contenant des pigments[3].
Biologie, écologie, éthologie
Ces protéines sont synthétisées et présentes par milliers dans chacune des cellules spécialisées (iridocytes ou chromatophores) des céphalopodes.
Elles permettent au système nerveux de ces animaux marins de gérer et manipuler la lumière incidente provenant de leur environnement[4].
Elles permettent aux coléoïdes prédateurs que sont les seiches, calmars et pieuvres de brutalement changer d’apparence et de couleur (en quelques millisecondes)[4].
Ces animaux peuvent ainsi utiliser leur peau pour communiquer avec d'autres individus de la même espèce (lors de la reproduction notamment) et/ou pour se camoufler dans leur environnement[4] ou encore pour améliorer leurs actions de prédation.
.jpg.webp)
(cliquer sur l'image pour l'agrandir)
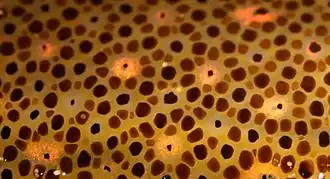
On pensait autrefois qu'un calmar, sur un fond clair, tendait instinctivement à contracter ces cellules pigmentées pour concentrer leur pigment dans des taches minuscules et très espacées, ce qui rendait sa peau plus claire. Inversement, sur un fond sombre, les cellules pigmentaires au contraire se dilateraient, diffusant le pigment sur une plus grande surface et rendant le corps plus sombre.
La réalité est bien plus complexe, grâce notamment aux protéines de la famille des réflectines
.jpg.webp)

.jpg.webp)


Aspects physicochimique et biochimiques
Les réfectines sont des protéines amphiphiles[6], riches en acides aminés aromatiques et soufrés[4].
Ces protéines qui présentent des propriétés particulières d'auto-organisation cyclique[7] pourraient être des protéines de type "Tonneau bêta"[8].
Il semble exister un processus en deux étapes :
- une neutralisation de charge déclenche une condensation rapide des protéines qui produisent alors des structures auparavant cachées (« cryptiques ») ;
- ces nouvelles structures produisent un assemblage moléculaire, qui est réversible.
Des travaux d'observation du caractère cyclique de ce phénomène, et d'assemblage/désassemblage in vitro de ces complexes (probablement constitués de plusieurs milliers de molécules de réflectine) ont fait conclure à DeMartini et à ses collègues en 2015 que la spécificité intrinsèque d'une réflectine (et de la structure qu'elle détermine) régit les processus de condensation et assemblages réversibles de réflectines, et que ces processus suffisent à modifier l'indice de réfraction de la lumière reçue et renvoyée par la cellule, en modifiant l'épaisseur et l'espacement des « lamelles de Bragg » (intracellulaires) contenant la réflectine[9]. Ces changements modulent l'intensité, la couleur et l’iridescence de la lumière réfléchie[4].
Une hypothèse (posée en 2010 par Tao & al.) est que ces protéines s'auto-associent de façon réversible pour former un réseau de type « hydrogel »[10].
On peut donc parler de « métastabilité » pour les réflectines ; permise par ce mécanisme moléculaire qui pilote les métamorphoses biophotoniques de la peau de l'animal qui en est doté[4] - [11].
Histoire évolutive
L'évolution a fait émerger (au moins depuis un demi-milliard d'années probablement[12]) divers types de réflecteurs intradermiques cellulaires rendant des animaux capables de produire des iridescences[13] - [14] - [12] mais seuls les chromatophores des céphalopodes semblent être adaptatifs et présenter un tel degré de sophistication[15] - [16].
Génomique
Les gènes de réflectines d’autres espèces de céphalopodes ont été séquencés.
Selon les premières études phylogénétique disponibles, l'histoire évolutive de ces gènes serait complexe, ayant connu « une diversification potentielle de trois formes ancestrales de réflectines putatives ».
En 2013, une étude a conclu chez S. Officinalis à l'existence d'au moins 6 gènes codant les réflectines, et cette diversité ne semble pas associée à une expression tissu-spécifique[17]. Ces gène sont exprimés dans de nombreuses parties du corps chez l'embryon avant l'éclosion. Une colocalisation de deux gènes différents de réflectine a été démontrée[17]. Les auteurs (Andouche & al.) notent que « Curieusement, l'expression de l'ARNm de la réflectine n'était plus détectable au moment de l'éclosion, alors que les protéines de la réflectine étaient présentes et donnaient lieu à une irisation visible »[17]. Plusieurs sous-types de réflectines sont combinés simultanément pour produire de l'iridescence et la production et traduction d'ARNm sont découplées dans le temps au cours du développement de l'« iridosome »[17].
Recherche
Une hypothèse qui principalement émergé dans les années 2010 est que chez les céphalopodes, la diversité des ultrastructures sous-jacentes de la peau, parfois dites photoniques (structures statique, adaptative, spéculaire, diffuse, à large bande, à bande étroite, etc.) est basée sur la diversité des réflectines ou leur combinaison : divers sous-types de réflectines agissent différemment (selon leur proportion, leur localisation, leur type d'activation...) ce qui expliquerait la performance photonique de ces tissus réfléchissant la lumière et se colorant dynamiquement selon l'environnement et « l'humeur » de l'animal[18] - [19] - [20] - [21] - [22] - [23] - [17].
La biomimétique, la photonique, la bioélectronique[24] et la biophotonique[11] sont mobilisés par diverses entités espérant pouvoir respectivement créer des matériaux et des dispositifs photoniques inspirés de la nature imitant notamment les capacités sophistiquées de manipulation de la lumière, qui permet le changement de couleur et la production d'iridescence sur la peau des céphalopodes[25], et la recherche militaire qui espère pouvoir améliorer ses techniques de furtivité et de camouflage dynamique en créant des objets, engins[26], vêtements ou matériaux de type "cape d'invisibilité, grâce à des iridophores artificiels[27] ou autres dispositifs électroniques adaptatifs de contrôle de la couleur[28] - [29]. La peau des céphalopodes a d'abord inspiré la conception de dispositifs de camouflage actifs dans la partie visible du spectre électromagnétique, avec de nombreuses applications industrielles et militaires possibles. Certains chercheurs se sont également intéressés à la possibilité d'invisibilité hors du spectre visible dans l'UV ou l'infrarouge par exemple, en s'inspirant des structures des réflectines pour fabriquer des revêtements de camouflage biomimétiques. En 2015, ils avaient déjà réussi à produire des autocollants transparents et flexibles dont la réflectance peut être contrôlée (passant du visible vers le proche infrarouge via un stimulus mécanique), laissant envisager la possibilité de produire des films souples permettant de masquer des formes et rugosités diverses face à l'imagerie infrarouge[30].
Les travaux de recherches portent donc notamment sur les structures, l'organisation et les fonctions supposées ou démontrées des réflectines. Celles-ci semblent jouer un rôle-clé dans ces processus propres à ce groupe de protéines[4]. Depuis les années 2010, on comprend mieux comment les sous-types de ces protéines contribuent à des assemblages réversibles lors d'ajustements dynamiques d'intensité et de couleurs d'iridescence pilotés par le système nerveux. Ce dernier pilote des réflecteurs intracellulaires (cellules de Bragg, spécialisées que sont les iridocytes) via l'acétylcholine qui induit une phosphorylation/déphosphorylation différentielle des réflectines.
Certains sous-types de réflectines semblent également associés à des tissus spécifiques[4], et des séquences spécifiques de réflectine semblent permettre le camouflage dynamique, via une accordabilité des réponses individuelles des iridocytes situés dans les tissus et au niveau sous-cellulaires. En 2015, DeMartini & al estiment que des rôles différents existent pour les différents sous-types de [4].
En 2016, Levenson et al. ont montré (en s'appuyant sur la microscopie électronique et l'analyse de la fluorescence) « que des changements réversibles dans la quantité de charges positives en excès dans les réflectines - comparable à celle produite par la phosphorylation - suffit à entraîner la "condensation" réversible et l'assemblage hiérarchique de ces protéines »[31].
L'irisation contrôlable de la peau du calmar par lui-même fait l'objet d'intenses recherches, souvent avec l'espoir de produire des biomatériaux à propriétés optiques intéressantes, ou des matériaux photoniques bio-inspirés et contrôlables[10] - [32] - [33], éventuellement via les biotechnologies[1] - [25] - [34] mais en 2017, la caractérisation des « actionneurs protéiques » contrôlant l'iridescence adaptative n'en est encore qu'à ses débuts.
Certains comme Wang & al (2014) estiment qu'on pourrait ainsi produire une peau synthétique (élastomère) dont non seulement la couleur et les motifs, mais également des microreliefs pourraient évoluer de manière adaptative[35].
Dans le domaine de la bioélectronique, on cherche à s'inspirer de la famille des réflectines pour imaginer de nouveaux systèmes de conduction de protons (conduction qui jouent un rôle majeur dans la nature, mais aussi dans certains dispositifs de production et stockage d'énergie renouvelable, notamment pour les piles, batteries et divers capteurs[6]. Selon Marco Rolandi[36] au début des années 2010, de premiers exemples ont été développés et intégrés dans un dispositif bioélectronique[24] ; Des réflectines naturelles ou mutées se montrent aussi efficace que les meilleurs conducteurs de protons artificiels disponibles (en 2014), ce qui laisse penser qu'elles pourraient être intégrées dans des transistors protoniques à base de protéines, et avoir des usages dans la prochaine génération de matériaux conducteurs proton et dispositifs protoniques (éventuellement biocompatibles)[6]
En 2015 Phan & al. ont montré que la réflectine constitue aussi un substrat efficace pour faire croître des cellules souches/progénitrices neurales humaines. Ceci pourrait éclairer l'embryogenèse des céphalopodes, mais aussi contribuer à « développer des dispositifs bioélectroniques améliorés à base de protéines »[37].
Voir aussi
Illustrations complémentaires
.jpg.webp) Calmar européen (Alloteuthis subulata), notamment étudié pour ses iridophores[38]
Calmar européen (Alloteuthis subulata), notamment étudié pour ses iridophores[38]
Articles connexes
- Camouflage actif
- Couleur des animaux
- Aposématisme
- Camouflage de mouvement
- Camouflage sous marin
- Cape d'invisibilité
- Furtivité
- Tonneau bêta
- chromatophore
- Réseau de Bragg
- Bioluminescence
Bibliographie
- Ball P (2015). Les Nanostructures pour créer de la couleur, un art inspiré par la nature. Photoniques, 42-47
- Bassaglia Y, Bekel T, Da Silva C, Poulain J, Andouche A, Navet S & Bonnaud L (2012). ESTs library from embryonic stages reveals tubulin and reflectin diversity in Sepia officinalis (Mollusca—Cephalopoda). Gene, 498(2), 203-211|résumé
- DeMartini DG, Krogstad DV, Morse DE (2013) Membrane invaginations facilitate reversible water flux driving tunable iridescence in a dynamic biophotonic system. Proc. Natl Acad. Sci. USA 110, 2552–2556. (doi:10.1073/pnas.1217260110)
- (en) Ryan M. Kramer, Wendy J. Crookes-Goodson et Rajesh R. Naik, « The self-organizing properties of squid reflectin protein », Nature Materials, vol. 6, no 7, , p. 533–8 (PMID 17546036, DOI 10.1038/nmat1930, Bibcode 2007NatMa...6..533K)
- (en) Wendy J. Crookes, Lin-Lin Ding, Qing Ling Huang, Jennifer R. Kimbell, Joseph Horwitz et Margaret J. McFall-Ngai, « Reflectins: The Unusual Proteins of Squid Reflective Tissues », Science, vol. 303, no 5655, , p. 235–8 (PMID 14716016, DOI 10.1126/science.1091288, Bibcode 2004Sci...303..235C)
- Ghoshal A, DeMartini D.G, Eck E & Morse D.E (2014). Experimental determination of refractive index of condensed reflectin in squid iridocytes. Journal of The Royal Society Interface, 11(95), 20140106.
- Ordinario D.D, Phan L, Walkup IV W.G, Jocson J.M, Karshalev E, Hüsken N & Gorodetsky A.A (2014) Bulk protonic conductivity in a cephalopod structural protein. Nature chemistry, 6(7), 596-602
- Sutherland R.L, Mäthger L.M, Hanlon R.T, Urbas A.M & Stone M.O (2008). Cephalopod coloration model. I. Squid chromatophores and iridophores. JOSA A, 25(3), 588-599.
Références
- Qin G, Dennis P.B, Zhang Y, Hu X, Bressner J.E, Sun Z, Crookes-Goodson W.J, Naik R.R, Omenetto F.G, Kaplan D.L (2012) Recombinant reflectin-based optical materials. J. Polym. Sci. B Polym. Phys. 51, 254–264
- Des tenues de camouflage ultra perfectionnées inspirées par le calamar, article de Axel Cereloz, publié le 12 septembre 2013, consulté le 14 octobre 2017
- Andouche A (2013) Étude au cours du développement de Sepia officinalis des structures tégumentaires à l’origine des motifs colorés (Doctoral dissertation, Paris 6)
- DeMartini, D. G., Izumi, M., Weaver, A. T., Pandolfi, E., & Morse, D. E. (2015). Structures, organization, and function of reflectin proteins in dynamically tunable reflective cells. Journal of Biological Chemistry, 290(24), 15238-15249
- Bassaglia Y, Bekel T, Da Silva C, Poulain J, Andouche A, Navet S & Bonnaud L (2012). ESTs library from embryonic stages reveals tubulin and reflectin diversity in Sepia officinalis (Mollusca—Cephalopoda). Gene, 498(2), 203-211|résumé
- Ordinario D.D, Phan L, Walkup IV W.G, Jocson J.M, Karshalev E, Hüsken N & Gorodetsky A.A (2014) Bulk protonic conductivity in a cephalopod structural protein. Nature chemistry, 6(7), 596-602
- Kramer R.M, Crookes-Goodson W.J, & Naik, R. R. (2007). The self-organizing properties of squid reflectin protein. Nature materials, 6(7), 533|Résumé.
- Weiss, Jamie L.; Evans, Nicholas A.; Ahmed, Tanweer; Wrigley, Jonathan D.J.; Khan, Shukria; Wright, Charles; Keen, Jeffrey N.; Holzenburg, Andreas; Findlay, John B.C. (2005). "Methionine-rich repeat proteins: a family of membrane-associated proteins which contain unusual repeat regions". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1668 (2): 164–74. . doi:10.1016/j.bbamem.2004.11.014
- Ghoshal A, DeMartini DG, Eck E, Morse DE (2013) Optical parameters of the tunable Bragg reflectors in squid. J. R. Soc. Interface 10, 20130386. (doi:10.1098/rsif.2013.0386)
- Tao A.R., DeMartini D.G, Izumi M, Sweeney A.M, Holt A.L, Morse D.E (2010) The role of protein assembly in dynamically tunable bio-optical tissues. Biomaterials 31, 793–801
- Levenson R et al. (2016) Cyclable Condensation and Hierarchical Assembly of Metastable Reflectin Proteins, the Drivers of Tunable Biophotonics | Journal of Biological Chemistry | 30 décembre 2015 | Doi: 10.1074/jbc.M115.686014 | résumé
- Parker A.R (2000) 515 million years of structural colour. J. Opt. A Pure Appl. Opt. 2, 15–28
- Denton E.J, Land M.F (1971) Mechanism of reflexion in silvery layers of fish and cephalopods. Proc. R Soc. Lond. B Biol. Sci. 178, 43–61
- Seago A. E., Brady P., Vigneron J. P., Schultz T. D (2009) Gold bugs and beyond: a review of iridescence and structural colour mechanisms in beetles (Coleoptera). J. R. Soc. Interface 6, S165–S184
- Mäthger L.M, Land M.F, Siebeck U.E & Marshall N.J (2003) Rapid colour changes in multilayer reflecting stripes in the paradise whiptail, Pentapodus paradiseus. J. Exp. Biol. 206, 3607–3613
- Vigneron J.P, Pasteels J.M, Windsor D.M, Vértesy Z, Rassart M, Seldrum T, Dumont J, Deparis O, Lousse V, Biró L.P, Ertz D, Welch V (2007) Switchable reflector in the Panamanian tortoise beetle Charidotella egregia (Chrysomelidae: Cassidinae). Phys. Rev. E Stat. Nonlin. Soft Matter Phys. 76, 031907
- Andouche A., Bassaglia Y., Baratte S., Bonnaud L. (2013) Reflectin genes and development of iridophore patterns in Sepia officinalis embryos (Mollusca, Cephalopoda). Dev. Dyn. 242, 560–571
- Crookes W.J, Ding L.-L, Huang Q.L, Kimbell J, Horwitz J, McFall-Ngai M.J (2004) Reflectins : the unusual proteins of squid reflective tissues. Science 303, 235–238
- Holt A. L., Sweeney A. M., Johnsen S., Morse D. E. (2011) A highly distributed Bragg stack with unique geometry provides effective camouflage for Loliginid squid eyes. J. R. Soc. Interface 8, 1386–1399
- Azumi M., Sweeney A. M., DeMartini D. G., Weaver J. C., Powers M. L., Tao A., Silvas T. V., Kramer R. M., Crookes-Goodson W. J., Mäthger L. M., Naik R. R., Hanlon R. T., Morse D. E. (2010) Changes in reflectin protein phosphorylation are associated with dynamic iridescence in squid. J. R. Soc. Interface 7, 549–560
- Weiss J. L., Evans N. A., Ahmed T., Wrigley J. D., Khan S., Wright C., Keen J. N., Holzenburg A., Findlay J. B. (2005) Methionine-rich repeat proteins: a family of membrane-associated proteins which contain unusual repeat regions. Biochim. Biophys. Acta 1668, 164–174
- Mäthger L. M., Senft S. L., Gao M., Karaveli S., Bell G. R. R., Zia R., Kuzirian A. M., Dennis P. B., Crookes-Goodson W. J., Naik R. R., Kattawar G. W., Hanlon R. T. (2013) Bright white scattering from protein spheres in color changing, flexible cuttlefish skin. Adv. Funct. Mater. 23, 3980–3989 CrossRefGoogle Scholar 31
- DeMartini D. G., Ghoshal A., Pandolfi E., Weaver A. T., Baum M., Morse D. E. (2013) Dynamic biophotonics: female squid exhibit sexually dimorphic tunable leucophores and iridocytes. J. Exp. Biol. 216, 3733–3741 Abstract/FREE Full Text 32
- Rolandi M (2014). Bioelectronics: A positive future for squid proteins. Nature chemistry, 6(7), 563-564 | résumé
- Walish, J. J., Kang, Y., Mickiewicz, R. A., & Thomas, E. L. (2009). Bioinspired electrochemically tunable block copolymer full color pixels. Advanced Materials, 21(30), 3078-3081.
- Rossiter J; Yap B; Conn A. (2012) Biomimetic Chromatophores for Camouflage and Soft Active Surfaces Bioinspir. Biomim, 7, 036009 | DOI: 10.1088/1748-3182/7/3/036009
- Manakasettharn S; Taylor J.A; Krupenkin T.N (2011) Bio-inspired Artificial Iridophores Based on Capillary Origami: Fabrication and Device Characterization | Appl. Phys. Lett.| 99, 144102 | DOI: 10.1063/1.3646394
- Kreit, E.; Mäthger, L. M.; Hanlon, R. T.; Dennis, P. B.; Naik, R. R.; Forsythe, E.; Heikenfeld, J. Biological vs. Electronic Adaptive Coloration: How Can One Inform the Other? J. R. Soc., Interface 2013, 10, 20120601 DOI: 10.1098/rsif.2012.0601
- Yu C; Li Y; Zhang X; Huang X; Malyarchuk V; Wang S; Shi Y; Gao L; Su Y; Zhang Y; Xu H; Hanlon, R.T; Huang Y; Rogers J.A. (2014) Adaptive Optoelectronic Camouflage Systems with Designs Inspired by Cephalopod Skins Proc. Natl. Acad. Sci. U.S.A., 111, 12998 | DOI: 10.1073/pnas.1410494111
- Phan L, Ordinario D.D, Karshalev E, Walkup IV W.G, Shenk M.A & Gorodetsky A.A (2015). Infrared invisibility stickers inspired by cephalopods. Journal of Materials Chemistry C, 3(25), 6493-6498
- Levenson, R., Bracken, C., Bush, N., & Morse, D. E. (2016). Cyclable Condensation and Hierarchical Assembly of Metastable Reflectin Proteins, the Drivers of Tunable Biophotonics. Journal of Biological Chemistry, 291(8), 4058-4068|http://www.jbc.org/content/291/8/4058.abstract résumé]
- Izumi M, Sweeney A.M, DeMartini D.G, Weaver J.C, Powers M.L, Tao A, Silvas T.V, Kramer R.M, Crookes-Goodson W.J, Mäthger L.M, Naik R.R, Hanlon R.T, Morse D.E (2010) Changes in reflectin protein phosphorylation are associated with dynamic iridescence in squid. J. R. Soc. Interface 7, 549–560
- Ryan M. Kramer, Wendy J. Crookes-Goodson et Rajesh R. Naik, « The self-organizing properties of squid reflectin protein », Nature Materials, vol. 6, no 7, , p. 533–8 (PMID 17546036, DOI 10.1038/nmat1930, Bibcode 2007NatMa...6..533K).
- Fudouzi H.(2011) Tunable structural color in organisms and photonic materials for design of bioinspired materials. Sci. Technol. Adv. Mater. 12, 064704
- Wang Q, Gossweiler G.R, Craig S.L & Zhao X (2014) Cephalopod-inspired Design of Electro-mechano-chemically Responsive Elastomers for On-demand Fluorescent Patterning Nat. Commun. | 5, 4899 |DOI: 10.1038/ncomms5899
- Marco Rolandi est membre du Department of Materials Science and Engineering de l'Université de Washington, à Seattle
- Phan L, Kautz R, Arulmoli J, Kim I.H, Le D.T.T, Shenk M.A, ... & Gorodetsky A.A (2015). Reflectin as a Material for Neural Stem Cell Growth. ACS applied materials & interfaces, 8(1), 278-284
- Mäthger LM, Denton EJ (2001) Reflective properties of iridophores and fluorescent ‘eyespots’ in the loliginid squid Alloteuthis subulata and Loligo vulgaris. J. Exp. Biol. 204, 2103–2118.