Réaction de Nef
La réaction de Nef est une réaction organique d'hydrolyse acide d'un sel de nitroalcane primaire ou secondaire (1) en aldéhyde ou en cétone (3) et en oxyde nitreux (4)[1] - [2] - [3] :
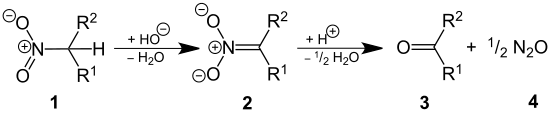
Cette réaction a été rapporté en 1894 par le chimiste John Ulric Nef[4] qui a traité ainsi le sel de sodium du nitroéthane par l'acide sulfurique obtenant un rendement de 85-89 % en oxyde nitreux et un rendement d'au moins 70 % en acétaldéhyde. Cependant, la réaction avait été déjà observée un an plus tôt par Konovalov[5] qui avait converti le sel de potassium du 1-phénylnitroéthane par l'acide sulfurique acétophénone.
La réaction de Nef ne doit pas être confondue avec la synthèse de Nef.
Mécanisme réactionnel
Le mécanisme réactionnel débute à partir de la forme mésomère (1a) du sel de nitro :
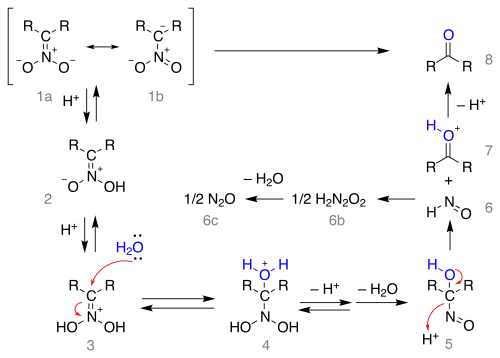
Le sel est protoné pour former le nitronate (2) — dans certains cas ces nitronates ont pu être isolés — puis une seconde fois en ion iminium (3). Cet intermédiaire est attaqué par l'eau par addition nucléophile formant l'adduit (4) qui perd ensuite un proton et une molécule d'eau pour former un 1-nitroso-alcanol (5) que l'on pense être responsable de la couleur bleue intense du mélange réactionnel dans la plupart des réactions de Nef. Cet intermédiaire se réarrange en acide hyponitreux (6) formant une molécule de protoxyde d'azote (6c) et un ion oxonium (7) qui perd un proton pour former le composé carbonylé.
On peut noter que pour que la réaction démarre, il faut que le nitroalcane de départ puisse prendre la forme mésomère favorable, ce qui nécessite un hydrogène en alpha, ce qui explique pourquoi la réaction échoue avec les nitroalcanes tertiaires.
Utilisation
La réaction de Nef est fréquemment rencontrée en synthèse organique. Elle a été appliquée en chimie des glucides comme méthode d'extension de chaîne pour les aldoses, par exemple pour le marquage isotopique du C14-D-mannose et du C14-D-glucose à partir du D-arabinose et du C14-nitrométhane, la première étape étant ici une réaction de Henry :
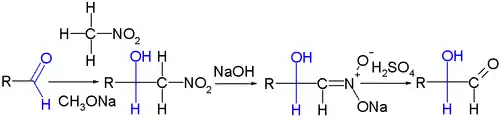
Cette réaction est l'opposée de la dégradation de Wohl.
Cette réaction peut aussi être utilisée en combinaison avec l'addition de Michael dans la synthèse de γ-céto-carbonyles tels que[6] :
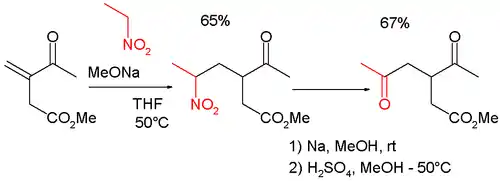
ou une 2,5-heptanedione[7].
L'hydrolyse des composés nitro avec un acide fort sans l'étape intermédiaire du sel résulte en la formation d'acides carboxyliques et de sels d'hydroxylamine.
L'étape d'hydrolyse de la réaction de Nef peut aussi être faite avec un acide de Lewis tel que le chlorure d'étain(IV)[8] ou des oxydants tel que l'oxone[9].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Nef reaction » (voir la liste des auteurs).
- (en) W. E. Noland, « The NEF Reaction », Chem. Rev., vol. 55, no 1, , p. 137–155 (ISSN 0009-2665, DOI 10.1021/cr50001a003).
- (en) H. W. Pinnick, Organic Reactions, vol. 38, New York (NY), John Wiley & Sons, , 832 p. (ISBN 978-0-471-51594-4, DOI 10.1002/0471264180.or038.03), chap. 3 (« The NEF Reaction »), p. 655-792.
- (en) D. S. Grierson et H.-P. Husson, Comprehensive Organic Synthesis, vol. 6 : Heteroatom Manipulation, Oxford (R.-U.), Pergamon Press, , 1194 p. (ISBN 978-0-08-040597-1, présentation en ligne), chap. 4.7 (« Polonovski- and Pummerer-type reactions and the Nef reaction »), p. 937-944.
- (de) J. U. Nef, « Ueber die Constitution der Salze der Nitroparaffine », Liebigs Ann. Chem., vol. 280, nos 2-3, , p. 263–291 (ISSN 0075-4617, DOI 10.1002/jlac.18942800209).
- Konovalov.,: J. Russ. Phys. Chem. Soc. 2 1893, 6(I), 509.
- (en) N. Lahmar, T. Ben Ayed et al., « A convenient synthesis of γ-functionalized cyclopentenones », Beilstein J. Org. Chem., vol. 1, no 11, (ISSN 1860-5397, DOI 10.1186/1860-5397-1-11, lire en ligne).
- (en) J. E. McMurry et J. Melton, « Conversion of Nitro to Carbonyl by Ozonolysis of Nitronates: 2,5-Heptanedione », Org. Synth., vol. 56, , p. 36 (ISSN 0078-6209, DOI 10.15227/orgsyn.056.0036).
- (en) M. Miyashita, T. Yanami et al., « Synthesis of 1,4-Diketones from Silyl Enol Ethers and Nitroolefins: 2-(2-Oxopropyl)Cyclohexanone », Org. Synth., vol. 60, , p. 117 (ISSN 0078-6209, DOI 10.15227/orgsyn.060.0117).
- (en) P. Ceccherelli, M. Curini et al., « Oxone® Promoted Nef Reaction. Simple Conversion of Nitro Group Into Carbonyl », Synth. Commun., vol. 28, no 16, , p. 3057-3064 (ISSN 0039-7911, DOI 10.1080/00397919808004885).